Персонализированная медицина
Персонализированная медицина — новая организационная модель построения медицинской помощи пациентам, которая основывается на подборе индивидуальных лечебных, диагностических и превентивных средств, оптимально подходящих по биохимическим, физиологическим и генетическим особенностям организма.
Основная цель нового направления в медицине заключается в персонализации и оптимизации профилактических мероприятий и лечения пациентов для исключения негативных последствий и осложнений, проявляющихся из-за индивидуальных особенностей.
Основные отрасли медицины, где применяются новые принципы — онкология, фармация и фармакогеномика. Последняя занимается изучением реакций организма на медицинские препараты в зависимости от индивидуальных наследственных факторов.
Однако развитие персонализированной медицины происходит и по другим направлениям: ревматология, кардиология, спортивная и профилактическая медицина.
Развитие персонализированной медицины
Персонализированная медицина имеет большой потенциал в сокращении затрат и реализации возможностей по безопасному и максимально эффективному медицинскому обслуживанию. Она делает лекарственные средства более индивидуальными. Одним из направлений, сосредоточенных на развитие персонализированной медицины является взаимодействие фармацевтического и диагностического направлений. Ученые, используя новейшие знания о молекулярных процессах патологий, снабжают врачей инновационными диагностическими методиками и тергетными препаратами. Последние имеют особое преимущество в лечении пациентов — прицельное воздействие на патологический очаг без вреда для здоровых клеток организма.
Принципы персонализированной медицины позволяют бороться с наиболее тяжелыми заболеваниями, добиваться значительных успехов, спасать жизни пациентов, улучшать самочувствие, расширять функциональные возможности. Чтобы создать индивидуально эффективные лекарственные препараты, необходимы знания о молекулярной природе патологических процессов, углубленном понимании персональных биологических различий каждого человека, механизме воздействия медикаментов. Задание персонализированной медицины — учесть все эти особенности и создать качественный препарат. Для этого необходимо проводить ряд исследовательских тестов, позволяющих определить наличие у человека определенных мутаций. Особенно важны мутационные изменения клеток при разработке лекарственных препаратов, предназначенных для лечения злокачественных опухолей.
Персонализированная медицина за границей: основные положения
Персонализированная медицина сравнительно новое направление, но уже имеет ряд основополагающих принципов:
- Прогностичность. Геномические исследования позволяют определить риски для здоровья пациента, на основании которых врачи составляют индивидуальный план предотвращения побочных эффектов.
- Проактивность. Индивидуальная профилактика, которая основывается на внесении коррективов в образ жизни, привычные действия. Может обеспечиваться за счет использования специальных добавок, отказа от вредных привычек, употребления фитокомплексов и других методов интегративной медицины.
- Превентивность. Врачи лечат пациента, а не его болезнь. Такой подход в персонализированной медицине позволяет сохранить здоровье, улучшить самочувствие и предотвратить развитие заболеваний на ранних стадиях.
- Персонализированность. Стратегические наработки терапии и профилактики разрабатываются и подстраиваются под индивидуальные особенности здоровья и болезни каждого конкретного пациента. Для этого предварительно требуется тщательное изучение генетического, экологического, клинического, геномного и социального профилей.
В Турции медицина считается приоритетной областью, которая хорошо финансируется государством. По этой причине все инновационные разработки доступны для диагностики и лечения в Турции. Пациентам обеспечивается качественные и эффективные программы оздоровления.
www.anadolumedicalcenter.ru
Личный подход. Что такое персонализированная медицина и как она работает | Здоровая жизнь | Здоровье
Более углубленное изучение состояния человека, работа с прицелом на будущее, более качественная профилактика — все это дает персонализированная медицина современным пациентам клиник. При этом, несмотря на широкую поддержку Минздрава, далеко не все знают и четко понимают, что именно скрывается под таким названием. О том, почему правило «4П» поможет человечеству эффективнее бороться с различными патологиями, и как именно работает персонализированная медицина, АиФ.ru рассказала
Основные принципы
Анна Шатохина, АиФ.ru: Наталья Александровна, расскажите подробнее, что такое персонализированная медицина? В чем ее основной принцип?
Наталья Бодунова: Персонализированная медицина — это современное направление в здравоохранении. Основными принципами ее являются:
— Предиктивность — возможность «предсказать» болезнь
— Профилактика — принять меры, чтобы заболевание не возникло
— Персонализация — индивидуальное лечение каждого
— Партисипативность — непосредственное участие пациента в процессе профилактики и лечения
Именно эти «4П» легли в основу перемен, происходящих сейчас в Российском здравоохранении.
— Чем отличается такой индивидуальный подход от стандартного, который используется на обычном приеме?
— Во-первых, современная медицина чаще задается вопросом не «чем болеет пациент?», а «чем может заболеть человек, и что мы должны сделать, чтобы это предотвратить?». То есть огромное внимание уделяется профилактике.
Во-вторых, у нас появились высокотехнологичные методы, с помощью которых можно не только определять диагнозы на ранних стадиях, иногда даже до появления у больного жалоб, но и назначать лекарственные препараты индивидуально — то есть в зависимости от тех или иных особенностей человека. Более того, существующие методы позволяют даже «предсказывать» заболевания, делать определенные «прогнозы» заболеваний и, соответственно, пытаться их предотвратить.
Но не нужно думать, что человек сможет «плюнуть в пробирку» и получить полный анализ всех своих показателей — все равно главным инструментом медицины всегда будет являться врач, который узнает историю болезни человека, тщательно расспрашивает о жалобах и использует свой опыт и профессионализм.
То есть персонализированная медицина — это вчерашний опыт + сегодняшние технологии.
— Существуют ли в мире аналоги? Какова позиция иностранных специалистов по данному вопросу?
— Сам термин «персонализированная медицина» пришел к нам из США в 1998 году после одноименной монографии, написанной Jain R.R. В Европе и США сейчас персонализированная медицина является ведущим направлением деятельности всех крупных клиник. Тем более, что будущее именно за высокотехнологичной, точной и профилактической медициной.
Чтобы внести ясность, приведу известный пример — Анжелину Джоли. Актриса прошла генетическое тестирование, которое показало, что у нее присутствуют гены BRCA1 и BRCA2. Это означает, что вероятность заболеть раком молочной железы составляет около 85%! Актрисе было предложено удаление молочных желез, чтобы избежать заболевания.— Какие методы и инструменты используются в персонализированной медицине?
— Методы персонализированной медицины — это сочетание высокого профессионализма врача, принципов доказательной медицины, «обычные» инструментальные исследования при необходимости, а также современная лабораторная диагностика.
Инновационным является попытка понять болезнь или предрасположенность к ней на клеточном уровне, оценить «молекулярные пути» заболевания, найти соответствующие биомаркеры — вещества, которые являются «знаками» той или иной болезни. Для этого используется генетика, геномика (раздел молекулярной генетики, посвященный изучению генома и генов — прим.ред.), протеомика (наука об изучении белков, их функций и взаимодействия в живых организмах — прим.ред.), а также метаболомика (наука об изучении уникальных химических «отпечатков пальцев», специфичных для процессов, протекающих в живых клетках — прим.ред.).
Можно предугадать
— Какие патологии можно предупредить с помощью такого варианта медицины?
— Существуют 2 вида болезней:
1. Моногенные — появление которых от нас не зависит и которые в любом случае появятся у человека, если он является носителем гена, отвечающего за болезнь
2. Мультифакториальные — то есть когда предрасположенность есть, но проявится болезнь или нет зависит от факторов внешней среды- питания, спортивных нагрузок- то есть образа жизни.
Предотвратить развитие моногенных болезней мы не можем. А вот мультифакториальные мы можем предотвратить или, как минимум, задержать их развитие.
Возможности методов персонализированной медицины в области мультифакториальных заболеваний достаточно широки. Определить предрасположенности можно к большому количеству патологий — начиная от панкреатита и заканчивая некоторыми видами онкологии. Это и сахарный диабет 2 типа, и гипертоническая болезнь, существуют даже маркеры, свидетельствующие о возможности возникновению инфаркта.
— Учитывая количество информации, которое можно узнать о пациенте с помощью методов персонализированной медицины можно предположить, что такая диагностика занимает много времени?
— На самом деле, предиктивная медицина даже экономит время и пациента, и врача. Во-первых, всегда лучше предупредить, чем лечить — и быстрее, и менее затратно. Во-вторых, полное обследование пациента в клинике персонализированной медицины займет всего 2-3 дня, включая медико-генетическое консультирование и необходимые лабораторные и инструментальные методы. Определение биомаркеров и генетическое тестирование может вообще занять 10 минут — для этого потребуется сдать анализ крови и/или слюну.
— После того как выясняются слабые стороны состояния человека, что ему дальше предлагается?
— После общения с врачом и обследования каждому пациенту составляется индивидуальная карта. В ней расписан план дальнейшего обследования, диетические рекомендации, физические нагрузки, если нужно — лекарственная терапия. Для каждого человека составляется уникальная программа, учитывая семейную историю, генетический код, наличие уже имеющихся заболеваний и даже вид деятельности, а также предпочтения в еде.
— Кому в первую очередь стоит обращаться в клинику персонализированной медицины? В каких случаях это особенно важно — выявить пораньше возможность проявления различных проблем со здоровьем у человека?
— Чаще всего к нам обращаются молодые (40-45 лет) мужчины и женщины, близкие родственники, которые перенесли какое-либо тяжелое заболевание. Наблюдая за страданием близкого, каждый сознательный человек начинает задумываться о том, можно было это предотвратить? Ждет ли это меня? Что я делаю для своего здоровья?
Ранняя диагностика важна во всех случаях! Нет «легких» или «тяжелых» болезней, для каждого болезнь — это как минимум стресс и снижение качества жизни. На каждую «поломку» в организме обязательно нужно реагировать для сохранения качества и продолжительности жизни.
В случае с неясным или редким диагнозом медико-генетическое консультирование зачастую помогает прояснить ситуацию.Также стоит обращаться людям, которым необходимо пожизненно или длительно принимать лекарственные средства для подбора дозировки с помощью фармакогенетики. Например, если дело касается антикоагулянтов. Ни для кого не секрет, что риск тромбозов после операции есть у каждого, и с этой целью назначают препараты, препятствующие ему. Как правило, выбор лекарства и его дозировки — это выбор врача, основанный на действующих медицинских стандартах. Но у каждого пациента своя скорость метаболизма — т.е. скорость, с которой препарат начнет свое действие и будет выводиться из организма. Методы фармакогенетики позволяют оценить метаболизм каждого обратившегося и выбрать лекарство и его дозу персонифицированно.
Еще одна ситуация, когда необходима помощь генетика — это планирование семьи. Женщинам, у которых были неудачные попытки выносить или зачать ребенка — в первую очередь. Пары, родственники которых имеют какие-либо наследственные заболевания, смогут узнать риски передачи этих патологий своим детям. Но, согласно исследованиям, даже если в семье будущих родителей все здоровы, существуют риски возникновения наследственных заболеваний, так как каждый из супругов может быть носителем определенных предрасположенностей, но не иметь при этом симптомов. Следовательно, генетический тест поможет узнать, есть ли носительство того или иного заболевания и каковы шансы появления у ребенка.
— Все ли врачи могут заниматься таким видом медицины? Или им требуется определенная подготовка?
Ранее мы уже говорили о том, что персонализированная медицина — это сочетание опыта и профессионализма врача и современных технологий. Такой подход подразумевает наличие в клинике современного оборудования, необходимого для полного инструментального и лабораторного обследования и команды специалистов, имеющих достаточную компетенцию, чтобы правильно интерпретировать полученные данные.
aif.ru
Персонализированная медицина. В чем ее преимущества и как она работает?
«Грядет эра персонализированной медицины и готовиться к ней нужно уже сегодня.»Джордж Черч
Что такое персонализированная медицина?
Персонализированная медицина – это абсолютно новое направление медицины в Украине, которое уже укоренилось во многих странах Европы и Америки.
По определению Коалиции персонализированной медицины: «Персонализированная медицина — это использование новых методов молекулярной диагностики и определения генома для увеличения эффективности лечения пациентов и определения их предрасположенности к тем или иным заболеваниям».
Основные принципы персонализированной медицины или «4П»:
— Предиктивность – прогнозирование возможного заболевания
— Профилактика — не дать заболеванию проявиться
— Персонализация —индивидуальный подбор схемы лечения
— Партисипативность — пациент сам участвует в профилактике и лечении заболевания
В чем ее преимущества перед традиционными подходом к лечению и диагностике заболеваний?
Индивидуальный подход дает возможность прогнозировать, какие методы лечения будут безопасными и эффективными для каждого пациента, а какие нет. Персонализированная медицина может рассматриваться как расширение традиционных подходов к пониманию и лечению болезней. Она дает возможность врачам выбрать терапию или протокол лечения, основанный на молекулярном профиле пациента, который может не только минимизировать побочные эффекты, но и обеспечить более успешный результат лечения.
Персонализированная медицина имеет потенциал изменить наше представление о выявлении и управлении проблемами со здоровьем. Уже сегодня индивидуальный подход к диагностике и лечению заболеваний активно используется в повседневной практике врачей всех специальностей. Потребность в персонализированном подходе с каждым днём возрастает по мере совершенствования нашего понимания о болезни и технологий.
Как работает персонализированная медицина на конкретных клинических примерах
Рак молочной железы. Один из самых ранних и наиболее распространенных примеров персонализированной медицины проявился в трастузумабе. Повышенная экспрессия гена HER2 наблюдается в 30% случаев рака молочной железы. Белок ассоциирован с агрессивностью опухоли, которая не реагирует на стандартную терапию, и неблагоприятным прогнозом. Ранняя и своевременная молекулярная диагностика гена позволяет применить Трастузумаб для пациентов с HER2-положительными опухолями уменьшил рецидивы на 52% в сочетании с химиотерапией.
Меланома. BRAF — ген человека, ответственный за производство белка, называемого B-Raf, который участвует в передаче сигналов внутри клеток для их прямого роста и, как показано, мутировал при меланоме. Препарат, называемый вемурафениб, ингибитор белка B-Raf, был одобрен для лечения поздней стадии меланомы. Вемурафениб работает только при лечении пациентов с положительными тестами на мутации данного гена. Около 60% пациентов с меланомой имеют мутацию BRAF и приблизительно 90% из них — мутацию BRAF V600E.
Аллергический ринит или поллиноз. Молекулярная аллергодиагностика является ярким пример персонализированной медицины, которая широко используется для подбора эффективного лечения (аллерген-специфической иммунотерапии (АСИТ), профилактики аллергических заболеваний, прогнозирования перекрестных реакций между аэро и пищевыми аллергенами, тяжелых системных реакций на пищевые продукты. Известно, что пациенты с аллергией на мажорную (главную) молекулу пыльцы березы Bet v1 имеют перекрестные аллергические реакции на косточковые фрукты (яблоки, персики, сливы и др.), орехи и некоторые виды овощей. Определение данного главного аллергена Bet v1 дает возможность подобрать компоненты аллерген-специфической иммунотерапии и вылечить пациента от аллергии, разработать рекомендации по термической обработке фруктов и овощей, чтобы уменьшить их аллергенность.
Кто нуждается в персонализированном подходе в первую очередь?
- Пациенты с наследственной предрасположенностью к заболеваниям, например, таких как рак молочной железы, бронхиальная астма или сахарный диабет.
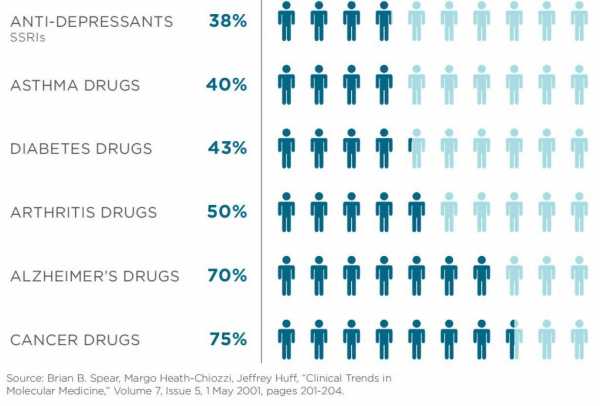
- Пациенты, для которых стандартные методы медикаментозного лечения не эффективные. Согласно статистическим данным, эффективность антидепрессантов не превышает 38%, противоопухолевых препаратов – 75%, медикаментозной терапии в лечении БА – 40%, сахарного диабета – 43%, артрита – 50%, болезни Альцгеймера – 70%. У каждого человека своя скорость метаболизма медикамента. Методы фармакогенетики позволяют оценить уровень метаболизма у пациента и подобрать лекарственный препарат и его дозу, а также спрогнозировать его эффективность.
Какая роль врача в персонализированном подходе к диагностике и лечения заболевания?
Ошибочно полагать, что персонализированная медицина основана только на лабораторной диагностике. Главным звеном является врач, высокий профессионализм которого позволяет тщательно изучить историю болезни и жизни человека, расспросить о жалобах, индивидуально подобрать диагностические методы и определить схему лечения.
Полная реализация персонализированной медицины включает:

Оценка риска:
Генетическое тестирование для выявления предрасположенности к болезни
Профилактика:
- Поведенческая терапия /
- Образ жизни /
- Лечение направлено на
- предотвращение болезней
Диагностика:
Раннее выявление заболевания на молекулярном уровне
Диагноз:
Точный диагноз включая индивидуализированную стратегию лечения
Лечение:
Использование таргетной терапии дает лучшие результаты и сокращение побочные эффектов от терапии
Наблюдение:
Активный мониторинг ответа на лечение и прогрессирование болезни
Персонализированная медицина направлена на:
- Сдвиг акцента от лечения симптомов заболевания на профилактику
- Индивидуальный подбор оптимальной терапии, не теряя времени на пробную неэффективную терапию
- Уменьшение побочных реакций на лекарства
- Повышение приверженности пациентов к лечению
- Улучшение качества жизни
- Выявление дополнительных или альтернативных лекарственных препаратов
- Снижение общей стоимости медицинского обслуживания
Персонализированная медицина и аллергология
Ведущим направлением персонализированной медицины в аллергологии является определение индивидуальных фенотипов заболевания. Так, согласно GINA, выделяют несколько фенотипов БА у детей, диагностика которых помогает разработать более точную стратегию лечения и оценить прогноз: атопическая (вызванная аллергенами) БА, неаллергическая БА, БА при ожирении, вирусиндуцированная БА, БА, индуцированная физической нагрузкой, неуточненная БА. Определение фенотипов БА сегодня признана перспективным направлением для выявления критериев персонализированного назначения базисной противоастматической терапии.
Сегодня аллерген-специфическая иммунотерапия (АСИТ) – единственный этиотропный метод лечения аллергических заболеваний, который можно по праву назвать методом персонализированной медицины. АСИТ подбирается с учетом молекулярного механизма заболевания, идентификации причинно-значимого аллергена на молекулярном уровне (определение специфических молекул – компонентная аллергодиагностика), которые позволяют точно подобрать лечение в зависимости от фенотипа аллергического заболевания и прогнозировать эффективность АСИТ. Ранее аллергию лечили только симптоматически, современная же медицина предлагает персонифицированную терапию (АСИТ), основанную на фенотипических характеристиках, молекулярной диагностике, которая воздействует непосредственно на причину развития аллергии.
Персонализированная медицина в цифрах и фактах
fxmed.com.ua
Что такое персонифицированная медицина
26 сентября во Владимире состолась конференция, посвященная персонифицированной медицине. Что такое персонифицированная медицина и для чего она нужна? Об этом рассказывает Майра Буланова, д.м.н., главный терапевт Владимирской области.
Источник: www.dz.avo.ru
 Персонифицированная медицина прочно укоренилась в медицинской практике, и ее можно трактовать, как индивидуальный подход к каждому пациенту. Такой подход применяется к человеку даже когда он полностью здоров. Суть персонифицированной медицины — в индивидуальной профилактике, целенаправленной диагностике и особом, сугубо специфичном, выверенном лечении.
Персонифицированная медицина прочно укоренилась в медицинской практике, и ее можно трактовать, как индивидуальный подход к каждому пациенту. Такой подход применяется к человеку даже когда он полностью здоров. Суть персонифицированной медицины — в индивидуальной профилактике, целенаправленной диагностике и особом, сугубо специфичном, выверенном лечении.
Один из базисов концепции персонифицированной медицины – обязательные генетические исследования. Они стали возможными и доступными после расшифровки генома человека. Цель генетических исследований — не только выяснение, связано или нет развившееся заболевание с генетическими особенностями организма, но и определение вероятности развития того или иного заболевания у конкретного человека.
Например, есть группа пациентов с высоким риском развития сердечно-сосудистых заболеваний в молодом возрасте. В результате проведенных исследований установлено, что у них повышенная свертываемость крови, обусловленная генетическими особенностями — аномалиями одного или нескольких генов. И вот мы как раз определяем, каков шанс развития болезни, насколько вероятны повторные инсульты или инфаркты, вызванные не атеросклерозом, а тромбофилией – той самой аномально высокой свертываемостью крови. Если риски велики, человеку необходима пожизненная профилактика, направленная на предупреждение повторной закупорки сосуда. При этом крайне важно обследовать ближайших родственников пациента с целью выявления у них таких же аномалий для предупреждения развития болезни.
Российская медицина всегда стояла на принципах персонифицированной медицины. Усредненные стандарты – не наше изобретение, и пришли они из западной медицины. Эти стандарты в своем роде хороши для абсолютного большинства пациентов, но далеко не для всех.
Иногда на международных медицинских конференциях задают заковыристые вопросы насчет нестандартных клинических случаев. Западные врачи обязательно скажут о проведении сложных диагностических исследований — МРТ, МСКТ и т.д. Но в аудитории всегда найдется врач, который обратит внимание на необходимость расспроса пациента об истории развития недуга, о семейном анамнезе: кто в роду страдал теми или иными патологиями, как у ближайших родственников протекали заболевания. И этот ход мыслей выдаст врача из России.
Нашим врачам очень близок этот «новый» персонифицированный, по-русски — личностный, подход к ведению пациентов. Каждому студенту отечественного медицинского вуза известно высказывание одного из основателей русской терапевтической школы Матвея Яковлевича Мудрова — «врач лечит не болезнь, а больного». В русской школе врачей в первую очередь смотрели не на болезнь, а на пациента. Это заложено и бережно сохраняется в нашей системе образования, закреплено в медицинской ментальности и неплохо стыкуется с принципами строгих рекомендаций, стандартами и порядками медицины, основанными на доказательствах.
С развитием современных технологий принцип индивидуальности, непохожести, исключительности каждого человека вышел на качественно новый уровень и подкрепляется надежной диагностической базой, инновационными технологиями в фармакологии.
Приятие и принятие концепции персонифицированной медицины по согласованному мнению медицинского сообщества позволит значительно улучшить качество диагностики, лечения и — самое главное — предупреждения болезней. В перспективе нужно двигаться к созданию персонифицированного профиля пациента, его молекулярно-биологического паспорта, чтобы выявлять индивидуальные сбои в определенных механизмах, и на основе этих характеристик назначать лечение или профилактику.
www.vladokb.ru
Персонализированная медицина — Personalized medicine
Персонализированная медицина , точность медицины , или тераностика является медицинская модель , которая разделяет людей в различных группах, с медицинскими решениями, практики, мероприятий и / или продукции должны быть приспособлены индивидуально для каждого пациента в зависимости от их прогнозируемой реакции или риска заболевания. Термины персонализированной медицины, точность медицина, расслаивается медицина и P4 медицина используется взаимозаменяемы для описания этой концепции , хотя некоторые авторы и организации используют эти выражения отдельно указать конкретные нюансы.
В то время как подгонка лечения пациентов восходит по крайней мере ко времени Гиппократа , термин поднялся в использовании в последние годы , учитывая рост новых диагностических и информационных подходов , которые обеспечивают понимание молекулярных основ болезни, особенно геномики . Это обеспечивает четкую доказательную базу , на которой стратифицировать (группу) , связанные пациент.
Разработка концепции
В персонифицированной медицине, диагностическое тестирование часто используются для выбора подходящих и оптимальных методов лечения , основанных на контексте генетического содержания пациента или другого молекулярного или клеточного анализа. Использование генетической информации играет важную роль в некоторых аспектах персонализированной медицины (например , фармакогеномика ), и этот термин был впервые введен в контексте генетики, хотя с тех пор она расширилась , чтобы охватить все виды персонализации мер.
Фон
основы
Каждый человек имеет уникальный вариант человеческого генома . Хотя большинство различий между людьми не имеет никакого влияния на здоровье, здоровье индивида связано с генетической изменчивости с поведением и влияний окружающей среды.
Современные достижения в области персонализированной медицины полагаться на технологию , которая подтверждает фундаментальную биологию, пациент ДНК , РНК или белка , который в конечном итоге приводит к подтверждению болезни. Например, персональные методы , такие как секвенирование генома могут выявить мутации в ДНК , которые влияют на заболевания , начиная от муковисцидоза к раке. Другой метод, называемый РНК-сл , может показать , какие молекулы РНК связаны с конкретными заболеваниями. В отличие от ДНК, уровни РНК может изменяться в ответ на окружающую среду. Следовательно, последовательность РНК может обеспечить более глубокое понимание состояния человека здоровья. Недавние исследования связывают генетические различия между людьми с РНК выражения, перевода и уровней белка.
Понятия персонифицированной медицины могут быть применены к новым и трансформационных подходов к медико-санитарной помощи. Персонализированные здравоохранения основаны на динамике системной биологии и используют средства прогнозирования для оценки рисков для здоровья и разработать индивидуальные планы в области здравоохранения, чтобы помочь пациентам снизить риски, предотвратить болезнь и лечить ее с точностью, когда это происходит. Понятия персонифицированной медицинской помощи, получают все большее признание с Администрацией ветеранов передавания персонифицированного, проактивным ведомого уход за пациентами для всех ветеранов. В некоторых случаях персонализированное здравоохранение может быть адаптировано к разметке болезнетворного агента вместо генетической разметки пациента; примеры устойчивых к лекарствам бактерий или вирусов.
метод
Для того , чтобы врачи , чтобы знать , если мутация связана с определенным заболеванием, исследователи часто исследование называется « геном ассоциация исследованием » (GWAS). Исследование GWAS будет смотреть на одно заболевание, а затем последовательности генома многих пациентов с данной болезнью , чтобы искать общие мутации в геноме. Мутации, которые определяются быть связанно с заболеванием исследованием GWAS затем могут быть использованы для диагностики этого заболевания у будущих пациентов, глядя на их последовательности генома , чтобы найти ту же мутацию. Первый GWAS, проведенный в 2005 году, изучал пациент с возрастной макулярной дегенерацией (ВМД). Было установлено два различных мутаций, каждая из которых содержит только изменение только одного нуклеотида ( так называемый единичные нуклеотидные полиморфизмы , или ОНП), которое было связано с ВМД. GWAS исследование , как это было очень успешным в определении общих генетических изменений , связанные с заболеваниями. По состоянию на начало 2014 года, более 1300 исследований GWAS были завершены.
Оценка риска болезни
Несколько генов в совокупности влияют на вероятность развития многих распространенных и сложных заболеваний. Персонализированная медицина также может быть использована для прогнозирования риска человека для конкретного заболевания, на основе одного или даже нескольких генов. Этот подход использует ту же технологию секвенирования , чтобы сосредоточиться на оценке риски заболевания, что позволяет врачу начать профилактическое лечение до того , как болезнь представляет себя в своих пациентах. Например, если обнаруживается , что мутация ДНК увеличивает риск человека развития сахарного диабета 2 типа , этот человек может начать изменения образа жизни , что позволит уменьшить свои шансы на развитие сахарного диабета 2 типа в более позднем возрасте.
Приложения
Достижения в области персонализированной медицины позволят создать более унифицированный подход к лечению, специфичный для человека и его генома. Персонализированная медицина может обеспечить лучшие диагнозы с более ранним вмешательством, а также более эффективное развитие наркотиков и лечение.
Диагностика и вмешательство
Имея возможность взглянуть на пациента на индивидуальной основе позволит для более точного диагноза и конкретного плана лечения. Генотипирование представляет собой процесс получения последовательности ДНК индивидуума с помощью биологических анализов . Имея подробный отчет о последовательности ДНК индивидуума, их геном можно затем сравнить с эталонным геномом, как и у проекта генома человека , чтобы оценить существующие генетические вариации , которые могут учитывать возможные заболевания. Ряд частных компаний, таких как 23andMe , Navigenics и Illumina , создали прямой для потребителя секвенирование генома , доступной для общественности. Имея эту информацию от лиц , то может быть применено для эффективного лечения их. Генетический грим индивида также играет большую роль в том , как хорошо они реагируют на определенное лечение, и поэтому, зная их генетическое содержание может изменить тип лечения , которые они получают.
Аспект этого фармагенный , который использует геном человека, чтобы обеспечить более информированный и индивидуальный рецепт лекарства. Часто препараты назначают с идеей , что он будет работать относительно одинаков для всех, но в применении препаратов, существует ряд факторов , которые необходимо учитывать. Подробный отчет о генетической информации от человека поможет предотвратить неблагоприятные события, позволяет соответствующие дозировкам, а также создать максимальную эффективность с рецептами лекарств. Фармакогеномика процесс обнаружения генетических вариантов , которые предсказывают неблагоприятные события к конкретному препарату был назван toxgnostics .
Аспект theranostic платформы применительно к персонализированной медицине может быть использование диагностических тестов для руководства терапии. Тесты могут включать медицинскую визуализацию , такие как МРТ контрастных агентов (T1 и T2) агентов, флуоресцентные маркер ( органические красители и неорганические квантовые точки ), и агент ядерной визуализации ( ПЭТ Радиоактивных или SPECT агентов). или в пробирке лабораторных испытаний , включая секвенирование ДНК и часто связаны с углубленным изучением алгоритмов , которые взвешивают результат тестирования в течение нескольких биомаркеров .
В дополнении к специфической терапии, персонализированная медицина может значительно помочь прогрессу профилактической помощи. Например, многие женщины уже генотипирование для определенных мутаций в гене BRCA1 и BRCA2 , если они предрасположены из — за семейной истории рака молочной железы или рака яичников. Поскольку все больше причин болезней отображаются в соответствии с мутациями , которые существуют в пределах генома, тем легче они могут быть идентифицированы у индивидуума. Меры могут быть приняты для предотвращения заболевания из развивающихся. Даже если мутации были обнаружены в пределах генома, имеющей деталь их ДНК могут уменьшить воздействие или задержать начало некоторых заболеваний. Имея генетическое содержание личности позволит лучше руководствоваться решения в определении источника заболевания и , таким образом , лечения или предотвращения его его прогрессирование. Это будет очень полезно для лечения заболеваний , таких как болезнь Альцгеймера «s или рак , которые , как полагают, связаны с определенными мутациями в нашей ДНК.
Инструмент , который используется в настоящее время для проверки эффективности и безопасности лекарственного средства , специфической для целевой группы пациентов / суб-группы компаньона диагностики . Эта технология представляет собой анализ , который разработан во время или после того, как лекарственное средство становится доступным на рынке , и является полезным в повышении терапевтического лечения , доступного на основе личности. Эта диагностика компаньонов включила фармакогеномику информации , связанную с наркотиками в их рецепте этикетку в целях оказания помощи в принятии наиболее оптимального решения для обработки возможного для пациента.
Разработка лекарственных средств и использование
Имея геномную информацию индивидуума может быть существенным в процессе разработки лекарств, поскольку они ждут одобрения от FDA для общественного использования. Имея подробный отчет индивидуальной генетической макияж может быть основным активом в принятии решения, если пациент может быть выбран для включения или исключений в заключительной стадии клинических испытаний. Будучи в состоянии идентифицировать пациентов, которые получают наибольшую отдачу от клинического исследования позволит повысить безопасность пациентов от неблагоприятных исходов, вызванных продуктом в тестировании, а также позволит более мелкие и более быстрые испытания, которые приводят к снижению общих затрат. Кроме того, препараты, которые считаются неэффективными для большей части населения могут получить одобрение FDA на использование персональных геномов квалифицировать эффективность и необходимость для этого конкретного препарата или терапии, даже если это может понадобиться лишь небольшой процент населения.,
Сегодня в медицине, он является общим , что врачи часто используют метод проб и ошибок стратегии , пока они не найдут терапии лечения , который является наиболее эффективным для их пациента. С персонализированной медицины, эти процедуры могут быть более конкретно с учетом индивидуальных и дать представление о том , как их тело будет реагировать на лекарства и если препарат будет работать на основе их генома. Персональный генотип может позволить врачам получить более подробную информацию , которая будет направлять их в своем решении в лечебных рецептов, который будет более экономически эффективным и точным. Как цитата из статьи Pharmacogenomics: The Promise персонализированной медицины , «терапия с правом препарата в правильной дозе в правом пациенте» является описанием того , как персонализированная медицина будет влиять на будущее лечение. Например, тамоксифен используется как препарат часто назначают для женщин с ER + рак молочной железы, но только 65% женщин , принимающих изначально его разработали сопротивление. После некоторых исследований людьми , такими как Дэвид Flockhart , было обнаружено , что женщины с определенной мутацией в их CYP2D6 ген, ген , который кодирует фермент метаболизирующий, не смогли эффективно сломать тамоксифен, что делает его неэффективным для лечения их рака. С тех пор женщины в настоящее время для генотипирования этих специфических мутаций, так что сразу эти женщины могут иметь наиболее эффективную терапию лечения.
Скрининг этих мутаций осуществляется с помощью высокопроизводительного скрининга или фенотипического скрининга . Несколько обнаружения наркотиков и фармацевтические компании в настоящее время используют эти технологии не только продвигать изучение персонализированной медицины, но и для усиления генетических исследований ; эти компании включают Alacris тераностику, Persomics , Flatiron Здоровье, Novartis , OncoDNA и Foundation Medicine , среди других. Альтернативные многоадресные подходы к традиционному подходу трансфекции «вперед» библиотека скрининга может повлечь за собой обратную трансфекцию или chemogenomics .
Фармация рецептура еще одно применение персонализированной медицины. Хотя это и не обязательно с использованием генетической информации, настроенное производства лекарственного средства , чьи различными свойствами (например , уровень дозы, ингредиент выбор, способ введения и т.д.) выбирается и созданные для отдельного пациента принимаются в качестве области персонализированной медицины (в отличии для массового производства стандартных доз или комбинаций фиксированных доз) .
Дыхательная протеомики
Респираторные заболевания влияют на человечество во всем мире, с хроническими заболеваниями легких (например, астма, хроническая обструктивная болезнь легких, идиопатический легочный фиброз, среди других) и рака легких в результате чего обширные заболеваемости и смертности. Эти условия являются весьма неоднородны и требуют ранней диагностики. Однако, начальные симптомы неспецифичны, и клинический диагноз поставлен поздно часто. За последние несколько лет, персонализированная медицина стала подходом медицинской помощи, которая использует новую технологию, направленную на персонализировать лечения в соответствии с медицинскими потребностями конкретного пациента.
геномика рака
За последние десятилетия исследования рака обнаружило много о генетическом разнообразии видов рака , которые появляются в то же традиционной патологии . Там также было повышение информированности опухолевой гетерогенности , или генетического разнообразия в пределах одной опухоли. Среди других перспектив, эти открытия повышают вероятность обнаружения , что препараты , которые не дали хорошие результаты , применяемые к общей популяции случаев в еще может быть успешным для проценте случаев с определенными генетическими профилями.
Рак Genomics, или « oncogenomics » является применение геномики и персонализированной медицины для исследования и лечения рака. Секвенирования высокой пропускной методы используются для характеристики генов , связанных с раком , чтобы лучше понять заболевания патологии и улучшить развитие наркотиков . Oncogenomics является одним из наиболее перспективных отраслей геномики , в частности , из — за его последствий в лекарственной терапии. Примеры этого включают в себя:
- Трастузумаб (торговые названия Herclon, Herceptin) представляет собой моноклональное антитело , лекарственное средство , которое препятствует / NEU HER2 рецептора . Его основное назначение заключается в лечении некоторых форм рака молочной железы. Этот препарат используют только тогда , когда рак пациента проверяется на сверхэкспрессии рецептора HER -2 / NEU. Две ткани-печатая тесты используются для скрининга пациентов на возможные выгоды от лечения Герцептин. Тесты тканевые иммуногистохимии (IHC) и флуоресценция в гибридизация (FISH) Только Her2 + пациенты будут лечить с помощью Герцептин терапии (трастузумаб)
- Тирозинкиназы ингибиторы , такие как иматиниб (продаются как Гливек) были разработаны для лечения хронического миелоидного лейкоза (CML), в котором BCR-ABL слияние гены (продукт взаимной транслокации между хромосомой 9 и хромосомами 22) присутствуют в> 95 % случаев и производит hyperactivated ABL приводом сигнализации белка. Эти препараты специфически ингибируют белка Ableson тирозинкиназа (ABL) , и, таким образом , является ярким примером « рационального дизайна лекарств » , основанного на знании патофизиологии болезни.
- В докладе FoundationOne CdX производится Фондом медицины , который смотрит на генов в опухолевых биопсий отдельных пациентов и рекомендует определенные лекарственные препараты ,
проблемы
Как персонализированная медицина практикуется более широко, возникает целый ряд проблем. Современные подходы к правам интеллектуальной собственности, политике возмещения, конфиденциальности пациента и конфиденциальности, а также нормативному контролю должны быть пересмотрены и реструктуризацией , чтобы учесть изменения персонализированных медицины приведет к здравоохранению. Кроме того, анализ полученных диагностических данных недавний вызов персонализированной медицины и ее принятия. Например, генетические данные , полученные из следующего поколения секвенирования требует компьютер интенсивной обработки данных до его анализа. В будущем, адекватные инструменты будут необходимы для ускорения принятия персонифицированной медицины дальнейших областей медицины, что требует междисциплинарного сотрудничества экспертов из конкретных областей исследований, такие как медицина , клиническая онкология , биология и искусственный интеллект .
Регулирующий надзор
FDA уже начал предпринимать инициативы по интеграции персонализированной медицины в их регуляторную политику. Докладе FDA в октябре 2013 года под названием « Прокладывая путь для персонализированной медицины: роль FDA в новую эру медицинского развития продукта » , в котором они изложены шаги , которые они должны предпринять , чтобы интегрировать генетические и биомаркеров информацию для клинического применения и разработки лекарственных средств , Они определили , что они должны разработать конкретные нормативные стандарты науки, методы исследования, справочные материалы и другие инструменты для того , чтобы включить персонализированные медицины в их текущие практики регулирования. Например, они работают на «геномную справочную библиотеку» для регулирующих органов , чтобы сравнить и проверить правильность различных платформ секвенирования в попытке отстоять надежность.
право интеллектуальной собственности
Как и любое новшество в медицине, инвестиция и интерес к персонализированной медицине зависят от прав интеллектуальной собственности. Там было много споров по поводу патентной защиты для диагностических инструментов, генов и биомаркеров. В июне 2013 года Верховный суд США постановил , что природные гены , происходящие не могут быть запатентованы, а «синтетической ДНК» , который редактируется или artificially- создан еще может быть запатентована. Патентное ведомство в настоящее время рассматривает ряд вопросов , связанных с патентным законодательством для персонализированной медицины, например, является ли «Подтверждающие» вторичные генетические тесты опубликовать первоначальный диагноз, может иметь полный иммунитет от патентного законодательства. Те , кто выступает против патентов утверждают , что патенты на ДНК — последовательностей являются препятствием для текущих исследований в то время как сторонники указывают на освобождение от исследований и подчеркнуть , что патенты необходимы , чтобы побудить и защиты финансовых инвестиций , необходимых для коммерческих исследований и разработки и продвижения услуг.
Цепочка поставок
Там могут быть серьезные проблемы в производстве и поставке персонализированной медицины для пациентов с точки зрения цепочки поставок. Исторически сложилось, что фармацевтическое производство осуществляется в серийном производстве. Для многих из персонализированных терапии медицины , технология однократного применения требует гибкого и мелкого производства размера партии. Кроме того , поскольку эти методы лечения индивидуальны, нет места для ошибок в производстве, хранении и транспортировке этих лекарств. Органы управления должны быть помещены в цепочку поставок , чтобы исключить возможность ошибок — дорогое предложение для фармацевтических компаний. В дополнение к воздействию на процесс производства, расширенная цепочка поставок также будет оказывать существенное влияние. Сторонние поставщики, как логистические услуги, необходимо будет получить ближе к пациенту , чтобы координировать и пикап расписания и доставки из афереза сайтов.
политика Компенсации
Политика Компенсации должны быть пересмотрены , чтобы соответствовать изменениям , что персонализированная медицина принесет в системе здравоохранения. Некоторые из факторов , которые следуют учитывать , являются уровнем эффективности различных генетических тестов в общей популяции, экономическая эффективность по отношению к выгодам, как иметь дело с платежными системами для очень редких случаев, и как переопределяющем страхования понятия «общих риск» , чтобы включить эффект новой концепции«индивидуальных факторов риска». изучение, барьеров на пути использования персонализированной медицины рака молочной железы , приняли два различных диагностических тестов , которые BRACAnalysis и Oncotype DX. Эти тесты имеют более десяти дней поворот раз , что результаты в тестах неудовлетворительную и задержки лечения. Пациенты не возмещаемых за этих задержек , что приводит к тестам не заказанные. в конечном счете, это приводит к пациентам приходится платить из собственного кармана для лечения , потому что страховые компании не хотят принимать риски.
неприкосновенность частной жизни пациента и конфиденциальность
Пожалуй, наиболее важный вопрос с коммерциализацией персонализированной медицины является защита пациентов. Одна из самых больших проблем является последствием страха и потенциала для пациентов, которые предрасположены после генетического тестирования или обнаружатся, не реагирующие на определенные процедуры. Это включает в себя психологическое воздействие на пациентов из-за результатов генетического тестирования. Право членов семьи, которые не имеют прямого согласия является еще одной проблемой, учитывая, что генетическая предрасположенность и риски являются наследуемыми. Последствия для некоторых этнических групп и наличия общего аллель также должны быть рассмотрены. В 2008 году Закон о генетической информации Nondiscrimination (GINA) был принят в попытке свести к минимуму страх пациентов, участвующих в генетических исследованиях, гарантируя, что их генетическая информация не будет злоупотреблять работодателями или страховыми компаниями. 19 февраля 2015 FDA выпустило пресс-релиз под названием: «FDA допускает маркетинг первого испытания генетических несущего прямой к потребителю при синдроме Блума.
Смотрите также
Рекомендации
ru.qwertyu.wiki
Персонифицированная медицина
Руководитель центра: заведующая кафедрой микробиологии ИФМиБ КФУ, в.н.с. НИЛ Маркеры патогенеза Ольга Николаевна Ильинская;
Научный руководитель центра: директор Программы Инноваций в превентивной медицине и диагностике РИКЕН Йошихиде Хаяшизаки.
В структуру центра превосходства “Персонифицированная медицина” входят:
НИЛ “Экстремальная биология”
Руководитель: Гусев Олег Александрович, PhD (биологические науки), ведущий научный сотрудник, ассистент кафедры зоологии и общей биологии ИФМиБ КФУ, (h-index-9)
Лаборатория занимается изучением, обитающего в Нигерии комара-звонца Polypedilum vanderplanki – одного из сложно устроенных представителей животного мира, способных выживать при отсутствии воды в его организме.
Изучение этого насекомого может дать нам возможность безводного хранения восстанавливаемой еды, биоматериалов, биообъектов, семян растений – всего того, что космонавты могут использовать во время полета, в том числе, в экспериментальных целях. И, самое главное, без невероятного количества электроэнергетических затрат, что в условиях космического полета – бесценно.
Помимо способности к ангидробиозу (жизни без воды), в лаборатории изучают и млекопитающих, способных к погружению в глубокий сон – спячку, используя интереснейшую группу грызунов – сонь. Потому что атрофия скелетных мышц, в условиях длительной иммобилизации и микрогравитации у большинства млекопитающих, в частности у человека, остается актуальной проблемой в медицине, физиологии и космической биологии.
Так же, лаборатория совместно со специалистами Республиканского клинического онкологического диспансера (РКОД) проводит исследования на тему «Этноспецифические особенности генов–онкомаркеров населения Республики Татарстан».
НОЦ доказательной медицины «Кокрейн Россия»
Руководитель: Зиганшина Лилия Евгеньевна, д.м.н., профессор, заведующая кафедрой фундаментальной и клинической фармакологии ИФМиБ КФУ, директор Кокрейн Россия (Российского филиала Северного Центра Кокрейн), и.о. руководителя Научно-образовательного центра доказательной медицины «Кокрейн Россия» ИФМиБ КФУ
НИЛ «SIM», проект «Виртуальные и симуляционные технологии в биомедицине»
Руководитель: Кугуракова Влада Владимировна, старший преподаватель кафедры интеллектуальной робототехники ВШ ИТИС, руководитель Digital Media Lab – учебно-практическая лаборатория визуализации и разработки игр ВШ ИТИС
Область проводимых фундаментальных исследований в лаборатории довольно широка – это и разработка математических моделей базовых манипуляций для реализации виртуальных открытых хирургических операций, и разработка инструментария средств обратной связи широкого спектра видов отдачи с высокой иммерсивностью в виртуальных средах, и разработка инновационных подходов для реабилитации неврологических пациентов, и разработка численной модели морфологии реалистичной нейронной сети гиппокампа.
В процессе работы эти исследования должны воплотиться в следующие прикладные разработки: комплекс высокореалистичных тренажеров виртуальных открытых хирургических операций, комплекс реабилитационных тренажеров с использованием сенсоров-дальномеров или обработкой данных видеопотока, а также комплекс для визуализации биоэлектрической активности структур растущего мозга.
Также в лаборатории на стадии исследования находится проект создания персонализированной цифровой анатомо-физиологической 3D модели пациента, которая должна обеспечить практикующих врачей новой формой представления информации о состояниях и особенностях внутренних органов пациента на основе динамического отображения процессов в тканях на анатомически правильную форму исследуемых структур.
НИЛ «Омиксные технологии» проект «Омиксы»
Руководитель: Владислав Моисеевич Чернов, д.б.н., профессор
В 21 веке биология вступила в постгеномный этап своего развития. Активно развиваются технологии, позволяющие многократно увеличить пропускную способность стандартных экспериментальных методов. «Омиксные» методы революционизировали методологию экспериментальной биологии, анализа данных и их интеграции. Усилился акцент на функцию, структуру, эволюцию геномов. Появилось целое созвездие очень эффективных экспериментальных дисциплин, называемых «-omics» (или «омиксные» технологии) по одинаковому окончанию: геномика, протеомика, транскриптомика, метаболомика… Сегодня мы имеем возможность анализировать первичные структуры геномов, экспрессию генов в них, выявлять различные уровни регуляции и взаимосвязи между ними. Инструментально произошел переход от микрочипов к так называемому высокопроизводительному полногеномному секвенированию, исследуется весь набор ДНК, содержащийся в отдельной клетке, клеточных популяциях или сообществах организмов и анализируется работа всех генов одновременно. Новые экспериментальные технологии порождают огромные объёмы данных, анализировать которые можно только методами биоинформатики, в основе которой лежит синтез биологических и математических знаний.
НИЛ «Молекулярные основы патогенеза и терапии опухолевых заболеваний», проекта «Мотоз»
Руководитель: Серебрийский Илья Генрихович, Assistant Professor (h-index — 21), Fox Chase Cancer Center– FCCC, США
Областью проводимых фундаментальных исследований являются молекулярные основы патогенеза и терапии опухолевых заболеваний, в частности для решения задач в области определения биомаркеров, исследования механизмов и разработки терапии онкологических заболеваний. Реализация проекта с использованием современных клеточных и молекулярно-биологических технологий позволит обеспечить подготовку кадров, способных на самом высоком уровне взаимодействовать с лечащими врачами-онкологами и реализовать на практике переход к персонализированной медицине.
В рамках развития персонализированной медицины активно используется получение и всесторонняя характеристика ксенографтов от пациентов максимально приближенных к клинике. Такие экспериментальные модели (ксенографты) становятся de-facto нормой в современных онкоцентрах и позволяют вырабатывать индивидуализированные рекомендации по применению лекарственных препаратов для онкологических больных.
НИЛ «Молекулярная генетика микроорганизмов», проект «Биопленка»
Руководитель: Каюмов Айрат Рашитович, к.б.н., доцент кафедры генетики КФУ
Областью проводимых исследований лаборатории являются:
– Исследование взаимодействия микроорганизмов между собой и организмом хозяина в составе микробных биопленок и роли этих взаимодействий в патогенезе заболеваний и лекарственной устойчивости и разработка способов борьбы с ними.
– Исследование молекулярных механизмов регуляции процессов реализации генетической информации микробной клетки, контроль транскрипции генов, адаптация клетки к стрессовым условия.
– Исследование закономерностей организации биомолекул методами статистической физики.
НИЛ «Медицинская информатика»
Руководитель: Соловьев Валерий Дмитриевич, математик, д.ф.-м.н., профессор. вице-президент исполкома Межрегиональной ассоциации когнитивных исследований, заместитель председателя редакционного совета серии ежегодников “Когнитивные исследования”.
Основные направления исследований:
I. Анализ данных (data mining) из базы медицинских записей университетской клиники
II. Разработка моделей и методов text mining, семантической обработки текстов в задачах анализа потребностей, предпочтений и поведения потребителей, грант РНФ № 15-11-10019
III. Компьютерная поддержка биомедицинских исследований.
НИЛ «Медико-психо-социальные маркеры здоровья», проект «Здоровье студентов»
Руководитель: Гайфуллина Раушания Фаритовна, к.м.н., доцент,
Реализуемый проект – панельное лонгитюдное исследование, в рамках которого осуществляется междисциплинарный анализ социального и физического здоровья студентов в динамике на протяжении всего периода обучения в вузе (4 года).
Цель – выявление динамики социального, физического и психологического здоровья студентов в институциональной среде вуза и определение ключевых внутренних и внешних факторов, которые оказывают на него влияние. Содержание исследования: четырехлетний полевой линейный эксперимент и мониторинг социального и физического здоровья студентов, поступивших в университет в 2015 г. на основе сравнения показателей исходного состояния здоровья студентов (на момент поступления) и конечного состояния здоровья (на момент выпуска из университета).
НИЛ «Маркеры патогенеза», проекта «Таргет»
Руководитель: Ольга Николаевна Ильинская, д-р. биол. наук, профессор, действительный член АН РТ, лауреат Государственной премии РТ
Лаборатория проводит разработку новых подходов терапии онкологических и сердечно-сосудистых заболеваний человека, исследования молекулярных и клеточных мишеней, обеспечивающих направленность действия новых терапевтических средств, разработку биотехнологий получения микробных ферментов как потенциальных противоопухолевых и противовирусных средств.
7p-medicine.kpfu.ru
Персонифицированная медицина
В последнее время персонифицированная, или, как ее еще называют – точная, – медицина получает все большее распространение как потенциально более эффективный подход к терапии трудноизлечимых патологических состояний и заболеваний, включая сложные формы онкологии. В рамках этого подхода исследователи стремятся точнее предсказать, какой тип лечения больше всего подойдет конкретному человеку, исходя из его генетических характеристик, факторов внешней среды и образа жизни.
Недавнее исследование, результаты которого были обнародованы в медицинском научном журнале Nature Medicine, продемонстрировало, что дальнейшая персонализация точной медицины может дать хорошие результаты в лечении форм рака, которые не отвечают на терапию наиболее используемыми сегодня методами.
Ученые, большинство из которых являются сотрудниками Калифорнийского университета в Сан-Диего, провели клиническое исследование с целью проверить, окажет ли персонализированная комбинированная терапия положительный эффект на людей с рефрактерными опухолями, то есть опухолями, которые не ответили на ранее проведенное лечение. В поисках комплексного лечения, максимально соответствующего случаю конкретного пациента, они проанализировали специфические мутации опухоли каждого участника исследования и попытались подобрать препараты, которые бы прицельно воздействовали на каждую из мутаций.
«Положительный ответ на терапию, предполагающую воздействие только на одну альтерацию, как правило, бывает низким и краткосрочным, – отмечает старший автор исследования доктор Джейсон Сиклик. – Наш подход не ограничивается воздействием на единственную мутацию. В сотрудничестве с многопрофильной командой экспертов в области онкологии мы разрабатываем персонализированные схемы комплексного лечения для каждого пациента».
«Использовав этот поход, – продолжает доктор, – мы увидели, что количество пациентов, положительно ответивших на лечение, увеличилось, так же как выросли показатели общей выживаемости и выживаемости без признаков прогрессирования заболевания среди пациентов, которым терапия была подобрана максимально точно. А вот результаты участников, которые получали стандартное или не очень точно подобранное лечение, были значительно хуже».
Результаты проспективного исследования
Для своего исследования, которое они назвали программой изучения фактических данных, определяющих персонализированное лечение рака (I-PREDICT – с англ. «я предсказываю»), ученые пригласили людей с метастатическими опухолями. Каждый из них ранее прошел лечение в одном из двух онкологических центров США: Мурзовском центре рака в Ла-Хойя, Калифорния, или центре Авера в Су-Фолс, Южная Дакота.
В общей сложности для участия в эксперименте зарегистрировались 149 человек с метастатическим, рефрактерным раком, 73 из которых (49%) удалось подобрать персонализированное комплексное лечение. Ученые не смогли провести лечение 66 зарегистрированным участникам, потому что болезнь у них прогрессировала чрезвычайно быстро, либо находилась на продвинутой стадии.
Чтобы подобрать методику, которая наилучшим образом справится с опухолью конкретного пациента, исследователи провели секвенирование ДНК раковых клеток каждого из них для определения характерных для них специфических мутаций. Затем с помощью специальных компьютерных программ они обработали данные по тысячам разновидностей генов, сотням лекарственных препаратов и миллионам схем лечения. Среди них и новые методы иммунотерапии, и традиционная «химия», и гормональное лечение, и препараты, ранее не использовавшиеся для борьбы с онкологией.
После этого авторы проконсультировались с командой специалистов, включающей онкологов, фармакологов, онкобиологов, хирургов и генетиков, которые помогли им подобрать наиболее подходящие варианты комбинированного лечения для каждого участника. Чтобы определить оптимальную для человека схему терапии, ученым пришлось сопоставить более 50% обнаруженных в его опухоли мутаций с препаратами, воздействующими на каждую из них в отдельности.
В результате половина пациентов, которым подобрали максимально соответствующую их случаю терапию, ответили на нее, в то время как среди тех, кто получал стандартное, не персонализированное лечение, положительная реакция была зафиксирована только у 22%.
«Тот факт, что 50% пациентов с тяжелой формой рака, ранее прошедших сложное безрезультатное лечение, ответили на индивидуально подобранную для них терапию, говорит о высокой значимости подходов, используемых персонализированной точной медициной, – говорит один из авторов исследования доктор Рацель Курцрок. – Наш следующий шаг – понять, сможем ли мы улучшить показатели эффективности, если начнем применять эту стратегию прежде, чем болезнь достигнет продвинутой стадии».
Не существует двух одинаковых опухолей
В общей сложности 83 участника исследования прошли лечение в соответствии с рекомендациями их лечащих врачей и их личными предпочтениями. Десять из них получили неперсонализированную терапию – то есть лечение не учитывало характер мутаций, присутствующих в их опухоли. Оставшимся 73 участникам было проведено персонифицированное комплексное лечение, сочетавшее самые разные противораковые методики, включая препараты, нацеленные на продукты конкретных генов, гормональную терапию, иммунную и химиотерапию.
«Процент пациентов, которым нам удалось подобрать максимально подходящее лечение, оказался гораздо выше, чем в большинстве ранних исследований, посвященных изучению точной медицины, потому как мы привлекли команду специалистов, которые сразу после получения данных секвенирования ДНК анализировали генетические особенности опухоли. Кроме того, мы использовали услуги координаторов, которые помогали пациентам и врачам получить доступ к нужным клиническим исследованиям и препаратам, которые не были одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для лечения рака», – отметил один из авторов эксперимента доктор Шумей Като.
Однако невзирая на очевидные преимущества нового подхода, у ученых есть определенные опасения относительно его реализуемости. По словам доктора Сиклика, персонализированная мультилекарственная терапия ранее не использовалась в качестве стандартного лечения, поскольку медики сомневались в безопасности введения комбинации препаратов, совместное действие которых прежде не было изучено.
В нынешнем исследовании ученые наблюдали за результатами лечения до тех пор, пока болезнь не развивалась дальше: больной либо переставал отвечать на терапию, либо умирал. Вместе с тем, старший автор исследования подчеркивает важность использования персонализированного подхода в лечении рака – насколько это возможно.
«Индивидуально подобранные схемы являются необходимостью. Сейчас, когда молекулярные механизмы развития опухолей изучаются все глубже, стало очевидным, что классифицировать их только по локализации, стадии и ткани нельзя. Совершенно понятно, что не существует двух абсолютно одинаковых раковых образований, поэтому не должно быть двух одинаковых терапевтических планов», – отмечает доктор Сиклик.
«Полученные нами результаты демонстрируют, что этот подход является вполне реализуемым и безопасным при условии, что пациентов тщательно наблюдают и лечение начинается со сниженных доз препаратов», – добавил ученый.
Вместе с тем, исследователи признают необходимость дальнейших клинических испытаний, которые должны подтвердить целесообразность использования этого метода.
Кроме того, многие члены исследовательской команды подтвердили, что получили финансовые средства на проведение эксперимента от разных фармацевтических и исследовательских компаний, в том числе Novartis Pharmaceuticals, Blueprint Medicines, Amgen и Pfizer.
docland.ru