Персонифицированная медицина — это медицина будущего — Сноб
МЕДСИ PREMIUM — новаторский проект, созданный на базе отделения персонифицированной медицины КДЦ МЕДСИ на Красной Пресне и расположенный в самом центре Москвы
Давид Матевосов, руководитель проекта MEДСИ Premium Фото: MEДСИПерсонифицированная, или персонализированная медицина — современный подход в здравоохранении, базирующийся на учете индивидуальных особенностей каждого человека. Это глубокое, подробное и полное изучение состояния здоровья пациента, персонально подобранные, соответственно — более действенные и безопасные способы лечения, своевременная профилактика заболеваний.
«Сегодня персонифицированную медицину называют медициной будущего, — говорит Давид Матевосов, руководитель проекта МЕДСИ Premium, кандидат медицинских наук, врач — гастроэнтеролог-гепатолог.
В основе работы МЕДСИ Premium новые принципы 4П:
· Персонифицированный подход — целевая диагностика и возможное последующее лечение пациента, основанные на клинических, генетических, геномных и средовых факторах.
· Предикция — выявление предрасположенностей на основе «паспорта здоровья», создание долгосрочного прогноза и рекомендаций.
· Партнерство — вовлеченность пациента в процесс лечения, объяснение всех назначений и медицинских манипуляций.
«Персонализация — это индивидуальный подход к каждому пациенту и в определении его особенностей, и в возможном последующем лечении, — поясняет Давид Матевосов. — Предикция — работа на будущее, определение проблемных зон. Современные способы обследования выявляют степень вероятности развития того или иного заболевания и позволяют их предотвратить или снизить риск появления проблемы. Превентивность — непосредственно комплекс мер для этого предотвращения или снижения риска: что важно, меры тоже подбираются индивидуально. Принцип партнерства между врачом и пациентом важен потому, что эффективность напрямую зависит от того, насколько пациент мотивирован, как хорошо он понимает, что происходит, и осознает ответственность за свое здоровье».
— Предикция — работа на будущее, определение проблемных зон. Современные способы обследования выявляют степень вероятности развития того или иного заболевания и позволяют их предотвратить или снизить риск появления проблемы. Превентивность — непосредственно комплекс мер для этого предотвращения или снижения риска: что важно, меры тоже подбираются индивидуально. Принцип партнерства между врачом и пациентом важен потому, что эффективность напрямую зависит от того, насколько пациент мотивирован, как хорошо он понимает, что происходит, и осознает ответственность за свое здоровье».
«МЫ СОБРАЛИ КОМАНДУ ПРОФЕССИОНАЛОВ, КОТОРЫМ МОЖНО ДОВЕРИТЬ САМОЕ ЦЕННОЕ — СВОЕ ЗДОРОВЬЕ»
МЕДСИ Premium — это:
• врач, который сопровождает пациента в течение всего процесса лечения;
• мультидисциплинарный подход профессиональной команды специалистов;
• привлечение профильных экспертов и проведение консилиумов;
• продолжительность приема специалиста — 1 час.

«Первое: тут работают специалисты по 15 разным медицинским направлениям. Все наши врачи — профессионалы, при этом они — сыгранная команда, — рассказывает Давид Матевосов. — Консилиумы, совместные консультации — чтобы подойти к каждой конкретной ситуации комплексно и всесторонне. Таким образом, мы слышим вас и слышим друг друга. Второй важный плюс МЕДСИ Premium и КДЦ на Красной Пресне, где он базируется, — это современная материально-техническая база центра. Вы можете быть уверены в том, что все диагностические и лечебные процедуры будут проведены на оборудовании экспертного уровня быстро, комфортно и безопасно, и самое важное — информативно. Третье: в МЕДСИ Premium — собственный клиентский сервис, который позволяет сделать комфортным пребывание в отделении, составить удобную программу маршрутизации, что помогает сэкономить ценные ресурсы — время и силы. Комплексные диагностические программы в МЕДСИ Premium можно пройти за 1-2 дня! Еще один важный момент: продолжительность приема составляет час — это дает возможность врачу и пациенту установить доверительные отношения и распланировать подходящий план диагностики и лечения».
В МЕДСИ Premium вы можете пройти обследование по следующим направлениям:
• Ультразвуковая диагностика
• Гинекология
• Кардиология
• Неврология
• Офтальмология
• Терапия
• Урология
• Эндокринология
• Эндоскопия
• Ревматология
• Диетология
• Гепатология
• Гастроэнтерология
• Дерматология
«Философия бренда — это качественная медицина и отличный сервис. Вместе с персонифицированным подходом и возможностями МЕДСИ Premium врачи отделения в кратчайшие сроки устанавливают диагноз и вырабатывают максимально эффективную стратегию лечения даже редко встречающихся заболеваний, — говорит Давид Матевосов.
МЕДСИ Premium — комфорт для взыскательных пациентов, которые заботятся о здоровье и дорожат временем:
• медицинский менеджер со знанием иностранных языков;
• удобное время записи на исследования и консультации специалистов;
• отдельная парковка, комфортабельная зона отдыха с доступом в интернет и ТВ;
• выделенный номер телефона.

Лицензия АО «Медси2» ЛО-77-01-016876 от 22.10.2018
Ул. Красная Пресня, 16
+7 (495) 730-7-730
www.medsi-premium.ru
Facebook
Instagram
Персонализированная медицина: что это такое и как это работает в Британии?
- Доктор Эмма Дэвенпорт
- Институт Сенгера, фонд Wellcome
Автор фото, Getty Images
Медицина всегда была в какой-то степени персонализированной — ведь при посещении врача тот всегда стремится предложить наиболее эффективное для вашего состояния лечение.
Но с развитием геномики впервые стало возможным подбирать лекарственные средства и методы лечения, которые подходят именно вашему организму.
Геном является полным описанием всего нашего набора ДНК, включая все гены. По сути это инструкция о том, как построить и поддерживать существование 37 триллионов клеток человеческого организма.
По сути это инструкция о том, как построить и поддерживать существование 37 триллионов клеток человеческого организма.
Более 99% ДНК совпадают у всех людей. Остающиеся структуры ДНК — меньше 1 процента — делают нас уникальными и могут определять тяжесть заболевания и эффективность лечения.
Исследование этих геномных различий помогает лечению целого ряда недугов — от рака и сердечно-сосудистых заболеваний до депрессии.
Рак и гены
Раковые заболевания — это область медицины, в которой наиболее развиты персонализированные формы лечения.
В Британии в государственной системе здравоохранения уже сейчас используются анализы ДНК для определения вероятности заболевания тем или иным видом рака.
Например, анализ мутаций генов BRCA1 или BRCA2 позволяет выявлять женщин, которые рискуют заболеть раком груди или яичников.
Мутации этих генов повышают риск заболеть раком груди в 4-8 раз. Это объясняет, почему в некоторых семьях такой рак встречается чаще. Мутация гена BRCA1 повышает риск заболевания раком яичников на 40-50%.
Это объясняет, почему в некоторых семьях такой рак встречается чаще. Мутация гена BRCA1 повышает риск заболевания раком яичников на 40-50%.
Автор фото, Getty Images
Такие исследования позволяют женщинам принимать обдуманные решения о дальнейших мерах предотвращения или лечения, например, делать ли мастэктомию (хирургическую операцию по удалению молочной железы).
При лечении некоторых видов рака измерение активности генов, которая может быть высокой, низкой или находиться на любом уровне между этими двумя показателями, становится обычным делом.
Например, в случае рака груди измерение активности 50 генов в опухолевых тканях дает представление о том, насколько эффективным окажется лечение методом химиотерапии.
Развитие персонализированной медицины
- В Англии геномное секвенирование (определение порядка расположения нуклеотидов в нуклеиновых цепях ДНК) предлагается всем английским детям, которые страдают редкими генетическими заболеваниями; в результате некоторым детям изменили методы лечения
- 11-летний ребенок стал первым пациентом, которому был прописано новое лекарственное средство CAR-T против лейкемии, перепрограммирующее иммунную систему для противодействия этому виду рака
- Полный геном женщин, которым поставлен диагноз рака груди, теперь определяется в Кембридже
- Существуют планы секвенирования 1 миллиона геномов в Британии в предстоящие пять лет
Образ жизни и генетика
Развитие новых методик ставит вопрос — каковы пределы персонализированной медицины?
В развитии таких заболеваний, как диабет, сердечно-сосудистая недостаточность и инфекционные болезни, решающим оказывается сочетание генетических факторов и образа жизни.
Автор фото, GOSH
Подпись к фото,11-летний Юван Таккар — первый в Британии пациент, который лечится от лейкемии препаратом CAR-T, разработанным на основе анализа его генома
Это означает, что сведения о различиях в геноме сами по себе оказываются недостаточными для прогноза риска заболевания и его исхода.
Измерение активности генов также дает информацию о стрессовой нагрузке, которую испытывает организм. Например, некоторые гены проявляют большую или меньшую активность в зависимости от типа инфекции.
Эти новые методы особенно эффективны при лечении сепсиса.
Сепсис — признак ошибок в работе иммунной системы, которая начинает повреждать собственные органы в борьбе с инфекцией.
Ежегодно от этого заболевания в Британии умирает 52 тысячи человек — больше, чем от рака груди, кишечника и простаты вместе взятых. В глобальных масштабах от сепсиса гибнет треть заболевших им пациентов.
Обычно для лечения сепсиса применяют антибиотики общего назначения для снятия первичного воспаления. Затем проводится анализ крови с целью определения, какая именно бактерия вызвала сепсис, чтобы подобрать более специализированные антибиотики.
Затем проводится анализ крови с целью определения, какая именно бактерия вызвала сепсис, чтобы подобрать более специализированные антибиотики.
Однако на эти анализы уходит драгоценное время, к тому же они не всегда могут выявить тип бактерии, вызвавшей инфекцию.
В рамках наших исследований мы отслеживаем активность генов иммунной системы пациента, чтобы определить, какие именно компоненты этой системы не работают. Это помогает врачам в выборе лекарственных препаратов.
Что дальше?
Персонализация лечения во многом зависит от скорости проведения анализов активности генов. В настоящее время они проводятся в лаборатории и занимают длительное время. Но врачам для выбора наиболее эффективной методики необходимо определять свойства генов в считанные минуты.
Автор фото, Getty Images
Ученые разрабатывают новую технологию, на основе которой уже создано устройство — микроэлектродный биосенсор, позволяющий в режиме реального времени отслеживать критические изменения в свойствах крови.
С помощью подобных новых методик геномная информация, в том числе данные об активности генов, может быть взята на вооружение терапевтами в больницах и поликлиниках.
Более того, геномная информация будет использоваться не только для лечения онкологических заболеваний, но гораздо шире.
Исследователи всё лучше понимают связь между геномной структурой и такими заболеваниями, как депрессия.
Они также работают с большими массивами генетических данных, таких как UK Biobank, с целью выявления людей с повышенным риском сердечно-сосудистых заболеваний.
Информация о вашем геноме вряд ли приведет к появлению персонализированной таблетки, которую будут прописывать только вам. Однако такие данные помогут врачам определять оптимальное сочетание лекарственных препаратов для конкретного человека на конкретном этапе его заболевания.
Об авторе
изменение подхода к применению лекарств
В компании «АстраЗенека» под понятием «персонализированная медицина» понимается применение таких лекарственных средств, которые окажутся наиболее эффективными для определенных групп пациентов.
Этот подход требует знания всех аспектов самого заболевания, выявления биомаркеров и разработку совокупности тестов, известных как сопутствующая диагностика. Их результаты помогают врачам выявлять тех, для кого таргетная терапия будет наиболее эффективной.
Огромный шаг вперед в области персонализированной медицины был сделан в области онкологии. Ярким примером может служить открытие в области лечения рака легкого, показавшее, что пациенты с наличием в их опухоли активирующей мутации гена эпидермального фактора роста будут с большей вероятностью реагировать на лечение, которое тормозит процесс деления.
Другая технология, за которой будущее – это секвенирование следующего поколения. Для поиска возможностей первого секвенирования генома человека потребовалось 10 лет научных исследований, вовлечение 200 ученых из различных стран мира, почти 3 млрд долларов США инвестиций. Сегодня это стало реальностью, процесс занимает несколько дней, его стоимость ниже 1000 долларов США.
Однако подобные научные достижения сопряжены и с определенными сложностями. Сейчас нет недостатка в получении генетических данных. Теперь вопрос заключается в том, как справиться с огромным объемом информации: как ее интерпретировать, превратить в знания и использовать на практике.
Интерес «АстраЗенека» в области персонализированной медицины гораздо шире лечения онкологической патологии, он распространяется на все ключевые терапевтические области компании. Ведь, например, сердечно-сосудистые заболевания и нарушения обмена веществ могут быть вызваны совокупностью экологических и генетических факторов. Несмотря на то, что первые являются основной причиной смертности в мире, сегодня открыто малое число генов, которые способствуют риску развития этих болезней.
Персонифицированная медицина? Что это такое?
В Астраханской клинической больнице ФГБУЗ ЮОМЦ ФМБА России освоены и активно работают новые методы, делающие персонифицированную медицину реальностью.
В чем суть персонифицированной медицины?
Хотели бы вы, чтобы лечение, назначенное врачом-кардиологом, учитывало вашу генетическую предрасположенность к ряду сердечно-сосудистых заболеваний? Вы думаете, что такое невозможно? А вот и возможно!
Именно генетический паспорт здоровья, содержащий информацию об особенностях структуры ДНК, индивидуальной предрасположенности к ряду наследственных заболеваний, лежат в основе ПЕРСОНИФИЦИРОВАННОЙ МЕДИЦИНЫ ХХI века.
Иными словами, это не что иное как индивидуальный подход к конкретному пациенту, рекомендации для него и его лечащего врача по профилактике заболеваний с повышенным риском.
Например, для оценки сердечно-сосудистого риска в настоящее время в основном используются такие показатели, как возраст, пол, уровень артериального давления, уровень показателей липидного спектра крови, наличие сахарного диабета, хронической болезни почек, курение и др.
Чем еще поможет персонифицированная медицина?
При такой проблеме как развитие побочных реакций во время лечения или отсутствие эффективности лекарственных препаратов. Связано это с тем, что именно генетические особенности пациентов в наибольшей степени определяют «фармакологический ответ» на применение лекарственных средств и, прежде всего, развитии нежелательных лекарственных реакций. Одна из главных задач персонифицированной медицины – избежать нежелательных побочных эффектов в процессе лечения.
Данный подход позволит предсказать возможность развития заболеваний, особенности их течения и вероятность осложнений индивидуально для каждого пациента.
Что такое персонализированная медицина?
Именно такая персонализированная медицина, направленная на лечение конкретного больного, а не на лечение болезни, должна совершить переворот в здравоохранении и повысить его безопасность, рентабельность и, что наиболее важно, его профилактическую и клиническую эффективность.
Фармакогеномика– это ключевой термин, относящийся киспользованию содержащейся в геномеинформации, общей для всех людей и необходимый для разработки лекарственныхпрепаратов.
Фармакогенетика– этот термин применяют для описанияработ по изучению влияния индивидуальныхгенетических вариаций (аллелей),встречающихся у разных людей, на реакцииих организма на лекарственные средства.
Генетическиевариации, обуславливающие индивидуальныйответ на лечение, могут относиться какк одному гену (кодируемому им белку),так и к комбинации генов/белков. Например,некоторые анальгетики проявляютактивность только в том случае, еслиферменты организма трансформируют ихв активную форму. Сами по себе такиепрепараты не активны. Эффективностьтаких препаратов значительно варьируетот человека к человеку. Наглядныйпример — незначительные индивидуальныегенетические вариации влияют наактивность статинов, применяемых дляснижения уровня холестерина в кровипри лечении атеросклероза.
Специалистывесьма заинтересованы в разработкегенетических тестов для индивидуальногоподбора таких препаратов и их дозировок,которые будут эффективны именно дляконкретных пациентов. Это должнозначительно снизить количество случаев,когда «лечение не помогает». В целом,концепция персонализированной медициныуже оказывает сильное влияние наисследования в области ранней диагностикии лечения, в особенности, онкологическихзаболеваний.
Персонализированнаямедицина и рак
Препарат длялечения рака молочной железы Герцептин(Herceptin) – яркий пример фармакогеномногосредства. Получивший официальноеодобрение в 1998 году Герцептин блокируетбелковый рецептор HER2, повышенный синтезкоторого характерен для некоторыхагрессивных форм рака молочной железы.Такой патологический повышенный синтезэтого рецептора диагностируют с помощьюспециального теста, и соответственно,только таким пациентам Герцептин можетпомочь. Для пациентов с другими формамирака молочной железы этот дорогостоящий препарат бесполезен.
Для пациентов с другими формамирака молочной железы этот дорогостоящий препарат бесполезен.
Недавно на рынкепоявились новые диагностические тесты,позволяющие выявлять уровеньвосприимчивости пациентов к препаратамИресса (Iressa), Тарцева (Tarceva), Гливек(Gleevec) и Кампат (Campath), а также выявитьбольных, чьи опухоли уже приобрелиустойчивость к препарату Гливек.Существуют также тесты для подбораоптимальной дозировки мощныххимиопрепаратов для лечения детскойлейкемии. Эти тесты позволяют избежатьгибели пациентов от передозировки.
Одним их наиболееинтересных новых тестов являетсяOncotype DX, разработанный компанией GenomicHealth. Этот тест анализирует экспрессию21 гена для оценки риска развития рецидивоврака молочной железы и для прогнозаэффективности химиотерапии. Подвпечатлением от положительных результатовиспытаний этого теста Национальныйинститут здравоохранения США (NIH) в мае2006 года начал масштабное исследование,названное TAILORx (Trial Assigning Individualized Optionsfor Treatment [Rx]), задачей которого являетсяпрогнозирование рецидивов этогозаболевания и подбор оптимальноголечения с помощью теста Oncotype DX. Висследовании участвуют более 10000 женщин,проходящих лечение в 900 медицинскихучреждения США и Канады.
Висследовании участвуют более 10000 женщин,проходящих лечение в 900 медицинскихучреждения США и Канады.
Большое количествопрепаратов и диагностических тестов,предназначенных для повышенияэффективности лечения онкологическихзаболеваний, находится на разных стадияхразработки. По сути, в настоящее времяонкология находится на пороге новойэры, в которой опухоль будут лечитьисходя из ее генетического профиля, ане основываясь на ее локализации ворганизме.
Сам по себепринцип применения персонализированноймедицины в онкологии достаточно прост,однако, учитывая большое разнообразие«генетических уловок», используемыхопухолевыми клетками для обеспеченияи ускорения своего роста, для распространенияметастазов и для противостояния лечению,для осуществления этого принципанеобходимо провести грандиозные пообъему и стоимости исследования. Вдекабре 2005 года Национальный институтздравоохранения США объявил о намеренииих провести и обобщить все результатыв «Атласе онкогенома» (Cancer Genome Atlas). Цельпроекта — картирование и анализ всехиндивидуальных вариантов генов, связанныхс 250 формами рака. Причем не толькогенных вариаций, повышающих риск развитиярака, но и вариаций, способствующихросту опухолей, метастазированию иразвитию устойчивости к лечению.
Цельпроекта — картирование и анализ всехиндивидуальных вариантов генов, связанныхс 250 формами рака. Причем не толькогенных вариаций, повышающих риск развитиярака, но и вариаций, способствующихросту опухолей, метастазированию иразвитию устойчивости к лечению.
Другиеобласти применения персонализированноймедицины.
В декабре2004 года Управление по санитарномунадзору за качеством пищевых продуктови медикаментов США (FDA) одобрилоразработанный совместно компаниямиRoche и Affymetrix AmpliChip тест CYP450 Genotyping Test,позволяющий по образцам крови получатьо пациентах необходимую индивидуальнуюгенетическую информацию. Это позволитоптимизировать выбор и дозировкупрепаратов для лечения множествараспространенных заболеваний, в томчисле болезней сердца, психиатрическихзаболеваний и рака.
Тест анализируетодин из генов, кодирующих белки семействацитохрома Р450, активно функционирующиев клетках печени. Эти белки обеспечиваютрасщепление многих лекарственныхпрепаратов и токсичных соединений.Различные варианты этих генов обуславливаютразную скорость расщепления и метаболизмаопределенных препаратов в печенипациента, а в некоторых случаях –приводят и к невозможности их расщепления.Определяемый с помощью этого тестаспецифический фермент цитохром P4502D6играет важную роль в обеспеченииспособности организма метаболизироватьнекоторые весьма распространенныелекарственные средства, в том числеантидепрессанты, антипсихотики,бета-блокаторы и часть химиопрепаратов.
Эти белки обеспечиваютрасщепление многих лекарственныхпрепаратов и токсичных соединений.Различные варианты этих генов обуславливаютразную скорость расщепления и метаболизмаопределенных препаратов в печенипациента, а в некоторых случаях –приводят и к невозможности их расщепления.Определяемый с помощью этого тестаспецифический фермент цитохром P4502D6играет важную роль в обеспеченииспособности организма метаболизироватьнекоторые весьма распространенныелекарственные средства, в том числеантидепрессанты, антипсихотики,бета-блокаторы и часть химиопрепаратов.
AmpliChip былпервым тестом на основе ДНК-микрочипа,получившим одобрение FDA. Такой микрочипвыглядит как компьютерная микросхема,в ячейках которой находятся определенныефрагменты ДНК гена цитохрома P4502D6(ДНК-зонды).
Медицина,учитывающая расовую и половуюпринадлежность.
В 2005 году FDAвпервые одобрило препарат, предназначенныйдля лечения людей определенной расы. Препарат BiDil применяют для лечениясердечной недостаточности у пациентовс черным цветом кожи. Исходно, припроведении в 1990-х годах клиническихиспытаний этого препарата его активностьв большой разнородной популяции пациентовне отличалась от эффективности плацебо,однако достигала многообещающихпоказателей при лечении афроамериканцев.Дополнительные испытания толькоподтвердили эти результаты.
Препарат BiDil применяют для лечениясердечной недостаточности у пациентовс черным цветом кожи. Исходно, припроведении в 1990-х годах клиническихиспытаний этого препарата его активностьв большой разнородной популяции пациентовне отличалась от эффективности плацебо,однако достигала многообещающихпоказателей при лечении афроамериканцев.Дополнительные испытания толькоподтвердили эти результаты.
Несмотря нато, что BiDil является пока единственнымпрепаратом, одобренным для применениясогласно расовому признаку, такоеразличие оказываемых эффектов далеконе уникально. Многие лекарственныесредства, в том числе традиционныепрепараты для снижения артериальногодавления и антидепрессанты, демонстрируютзначительные вариации в эффективностии безопасности, обусловленные расовойпринадлежностью пациентов.
Например,при проведении масштабного испытанияпрепарата Козаар (Cozaar), широко применяемогодля снижения артериального давления, было установлено, что его эффекты менеевыражены при лечении чернокожихпациентов. Поэтому эти данные былидобавлены в инструкцию по применениюпрепарата. Аналогично, согласно недавнейпубликации в New England Journal of Medicine, интерферонгораздо менее эффективен при лечениигепатитов у чернокожих пациентов и чему белых пациентов не латиноамериканскогопроисхождения (19% и 52% реагирующих налечение пациентов соответственно).
Поэтому эти данные былидобавлены в инструкцию по применениюпрепарата. Аналогично, согласно недавнейпубликации в New England Journal of Medicine, интерферонгораздо менее эффективен при лечениигепатитов у чернокожих пациентов и чему белых пациентов не латиноамериканскогопроисхождения (19% и 52% реагирующих налечение пациентов соответственно).
Результатыодной из работ свидетельствуют о том,что вероятность реагирования опухолина препарат Иресса в три раза выше впопуляции японцев, что, скорее всего,обусловлено мутацией гена, кодирующегомишень препарата – рецептор к факторуроста эпидермиса.
Считается, что воснове большинства расовых, этническихи территориальных различий в реакцияхна лекарственные средства лежат мутации,изменяющие свойства рецепторов,биохимические механизмы и метаболизирующиеферменты. Знание этого открывает передспециалистами огромное количествонаправлений работы в областиперсонализированной медицины. Например,компания NitroMed коллекционирует генетическийматериал в надежде разработать тестдля идентификации пациентов, чувствительныхк BiDil вне зависимости от их расы. Ряддругих компаний занимается разработкойпрепаратов, действующих с учетом половыхразличий. Пример такого препарата -известный всем аспирин, которыйпредотвращает инфаркт миокардаисключительно у мужчин. В настоящеевремя, по крайней мере, одна компанияработает над препаратом для лечениярака легких, оказывающим более выраженноевлияние на женщин.
Ряддругих компаний занимается разработкойпрепаратов, действующих с учетом половыхразличий. Пример такого препарата -известный всем аспирин, которыйпредотвращает инфаркт миокардаисключительно у мужчин. В настоящеевремя, по крайней мере, одна компанияработает над препаратом для лечениярака легких, оказывающим более выраженноевлияние на женщин.
.
ЕвгенияРябцева
Интернет-журнал«Коммерческая биотехнология»http://www.cbio.ru/по материалам BIO.org.
Персонализированная медицина: перспективы использования нанобиотехнологий
Резюме. Обзор посвящен обсуждению перспективных направлений персонализированной диагностики и терапии в кардиологии и онкологии при использовании инновационных нанобиотехнологий. Приведены результаты основных исследований по данному вопросу.
Персонализированная (индивидуализированная, персонифицированная) медицина (ПМ) — сравнительно новое направление современной медицины, получившее развитие благодаря использованию методов направленного пациентассоциированного лечебно-диагностического воздействия, на основе учета влияний генетических, внешнесредовых и региональных факторов (Jain K. K., 2009a). Другими словами, это целевая диагностика (геномно-протеомная, метаболомная, транскриптомная) и лечение (индивидуально ориентированные воздействия, в том числе лекарственная, клеточная терапия) больного в соответствии с исходными результатами исследования его генетического профиля (Willard H.F., Ginsburg G.S. (Eds), 2009).
K., 2009a). Другими словами, это целевая диагностика (геномно-протеомная, метаболомная, транскриптомная) и лечение (индивидуально ориентированные воздействия, в том числе лекарственная, клеточная терапия) больного в соответствии с исходными результатами исследования его генетического профиля (Willard H.F., Ginsburg G.S. (Eds), 2009).
ПМ также является перспективной областью интеграции современных биотехнологических подходов в медицинской практике, оптимизирующих понимание патофизиологической основы развития заболеваний, а также особенностей их молекулярной диагностики и терапии. Кроме того, такие активно развивающиеся направления медико-биологических исследований, как фармакогеномика, фармакогенетика, метаболомика и другие «омики», в частности фармакопротеомика, фармакометаболомика, фармакоцитомика, вносят свой вклад в развитие ПМ (Zhou S.F. et al., 2008; Nordström A., Lewensohn R., 2010; Trent R.J., 2010).
Сегодня ПМ — бурно развивающаяся область медицинских знаний. Оценка Бостонской консалтинговой группы (Boston Consulting Group — BCG) свидетельствует, что до 2020 г. темпы роста ПМ составят 37% ежегодно (Jain K.K., 2009b).
Оценка Бостонской консалтинговой группы (Boston Consulting Group — BCG) свидетельствует, что до 2020 г. темпы роста ПМ составят 37% ежегодно (Jain K.K., 2009b).
Важно отметить, что современное развитие наномолекулярной медицины рассматривается в связи с применением нанобиотехнологий (Залесский В.Н., 2009). В то же время нанобиотехнологии вносят существенный вклад в развитие ПМ благодаря использованию инновационных методик для лечебно-диагностических целей (Hess H., Jaeger L., 2010).
В основе развития ПМ лежит анализ особенностей генома человека. Так, в клиническом плане в первую очередь речь идет о том, чтобы с помощью генного анализа установить, стоит ли вообще принимать тот или иной препарат. Это необходимо потому, что даже незначительные индивидуальные различия в ДНК у двух пациентов могут привести к тому, что одно и то же лекарственное соединение будет действовать на них совершенно по- разному (Willard H.F., Ginsburg G.S. (Eds), 2009).
В ПМ роль биомаркеров в качестве референтных точек для диагностики и терапии общеизвестна (Saito M. , Yoshino T., 2010; Sharon D. et al., 2010). С помощью биомаркерных молекул определяют, в частности, состояние процессов повреждения клетки, ДНК, РНК, а также наличие метаболитов или белков-предшественников, которые детектируются благодаря инновационным нанобиотехнологиям (Archakov A.I., Ivanov Y.D., 2007; Hess H., Jaeger L., 2010).
, Yoshino T., 2010; Sharon D. et al., 2010). С помощью биомаркерных молекул определяют, в частности, состояние процессов повреждения клетки, ДНК, РНК, а также наличие метаболитов или белков-предшественников, которые детектируются благодаря инновационным нанобиотехнологиям (Archakov A.I., Ivanov Y.D., 2007; Hess H., Jaeger L., 2010).
Наноматериалы, используемые с целью создания биометок, являются важнейшей составляющей биомаркерных исследований (Розенфельд Л.Г. и соавт., 2008). Внутриклеточные биомаркерные молекулы, отличающиеся хорошей водорастворимостью, биосовместимостью и флюоресцентными свойствами, а также высокой стабильностью в составе серебряно-дендримерных нанокомпозитов, широко применяются для лечения клеток in vitro (Lesniak W. et al., 2005; Stofik M. et al., 2009).
Квантовые точки — довольно устойчивые наноструктуры, которые используются как молекулярные метки в целях выявления поражений, в частности, на ранних стадиях развития процессов онкогенеза (Lee J. et al., 2010) и микрометастазирования (Mahmoud W. et al., 2010), а также позволяют оценивать их эффективность в качестве соединений-мишеней при индукции клеточной альтерации в процессе развития многих заболеваний (Derfus A.M. et al., 2007).
et al., 2010) и микрометастазирования (Mahmoud W. et al., 2010), а также позволяют оценивать их эффективность в качестве соединений-мишеней при индукции клеточной альтерации в процессе развития многих заболеваний (Derfus A.M. et al., 2007).
Протеомные технологии имеют существенное значение для выделения и идентификации биомаркерных молекул. Использование нанобиотехнологий для протеомного, нанопротеомного анализа в значительной степени оптимизирует современную протеомную базу исследований и облегчает выявление следовых количеств белковых аналитов, а также протеинов в чрезвычайно малых объемах исследуемых образцов.
Постоянное совершенствование инновационных нанобиотехнологий позволит широко использовать поверхностные характеристики наночастиц на этапах их взаимодействия с биомаркерными молекулами и последующего их разделения на основе использования методов высокочувствительного протеомного тестирования (Geho D.H. et al., 2006; Jain K.K., 2007). По-видимому, нанобиотехнологии будущего позволят создавать наноразмерные устройства для ускоренного скрининга биомаркерных молекул, идентифицирующих этапы развития сравнительно редко отмечающихся заболеваний человека (Archakov A. I., Ivanov Y.D., 2007).
I., Ivanov Y.D., 2007).
Существенная роль отведена нанобиотехнологиям в персонифицированной диагностике. Сегодня становятся очевидными высокие темпы оптимизации методов направленной диагностики ДНК, РНК и белков. Отмечается повышение их точности и чувствительности, превышающее общепринятые методы молекулярного анализа. Начиная с диагностики простых белковых молекул, ДНК, РНК и их функциональных субъединиц в наношкальном формате, нанобиотехнологические подходы обеспечивают высокую прецизионность протеомных методов исследования (Hess H., Jaeger L., 2010).
Нанобиотехнологии помогают преодолевать ограничения методов современной молекулярной диагностики и содействуют установлению быстрого, точного и наиболее полного диагноза, а также интеграции диагностических программ исследования с терапевтическими мероприятиями в рамках персонализированных подходов к пациенту (Jain K.K., 2007).
Развитие ПМ напрямую связано с информацией о геноме человека. Известно, что для расшифровки генома в 1990 г. правительство США санкционировало проект «Геном человека». Стоимость секвенирования (идентификации нуклеиновых оснований в молекуле ДНК) генома примата составила порядка 20 млн дол. США, его проведение потребовало 3–5 мес. Для удешевления процедуры секвенирования генома человека до порядка 1 тыс. дол. был открыт проект «Персональный геном», инициированный Гарвардским университетом (Davies K., 2010).
правительство США санкционировало проект «Геном человека». Стоимость секвенирования (идентификации нуклеиновых оснований в молекуле ДНК) генома примата составила порядка 20 млн дол. США, его проведение потребовало 3–5 мес. Для удешевления процедуры секвенирования генома человека до порядка 1 тыс. дол. был открыт проект «Персональный геном», инициированный Гарвардским университетом (Davies K., 2010).
Одним из наиболее перспективных методов секвенирования оказался метод, основанный на использовании физических различий между 4 нуклеотидами (Mirsaidov U.M. et al., 2010). Благодаря этим различиям оказалось возможным зарегистрировать, транспортируя ДНК через нанопору, электрический сигнал, возникающий в ее электронной структуре (Mirsaidov U.M. et al., 2010). Такой метод не предполагает использования процедуры амплификации, что значительно удешевляет технологию секвенирования до 1 тыс. дол. и повышает быстродействие процедуры. В созданном устройстве подсчета единичных олигонуклеотидов регистрируется изменение во времени электрического сопротивления стенок нанопоры с диаметром несколько нанометров при прохождении через нее молекулы ДНК (Xu M. et al., 2009).
et al., 2009).
Длительное время исследователи имели затруднения в тестировании последовательности оснований, поскольку ДНК совершала обратные (вперед, назад) движения в пределах нанопоры. Для удержания процесса перемещения ДНК в пределах нанопоры интенсивно разрабатываются способы стабилизации молекулы с применением электрической «ловушки» (Pettersson E. et al., 2009).
Современные инновационные технологии секвенирования генома (ДНК) позволяют сравнительно быстро и эффективно считывать геномную информацию непосредственно от этих молекул благодаря замедлению и контролю скорости движения молекул через поры наноразмерного формата (Mirsaidov U.M. et al., 2010).
Быстрое и эффективное секвенирование молекул ДНК человека сегодня стало реальным благодаря новаторской технологии декодирования молекул ДНК при их транслокации через нанопоры, размещенные на кремниевом чипе (Archakov A.I., Ivanov Y.D., 2007). Эта технология доступна для широкомасштабного геномного анализа с помощью серийно выпускаемых систем (454 Sequencing System), которые генерируют сотни тысяч высококачественных данных о секвенс-последовательностях за считанные часы. При этом платформа 454 Sequencing System может стать первой технологией секвенирования нового поколения, разработанной для применения в клинических условиях (Davies K., 2010).
При этом платформа 454 Sequencing System может стать первой технологией секвенирования нового поколения, разработанной для применения в клинических условиях (Davies K., 2010).
Особенно перспективным оказалось устройство, в котором измерения осуществляются на отдельной молекуле ДНК благодаря созданию мельчайших нанопор в графене (слое углерода толщиной всего в 1 атом) для регистрации перемещения отдельных молекул ДНК, проходящих через наноразмерную пору (Schneider G.F. et al., 2010). Оказалось, что находящуюся в водном растворе молекулу ДНК можно транспортировать через графеновую нанопору, и, что особенно важно, отдельно каждую молекулу ДНК можно выявить по падению электрического тока в области нанопоры. Такая нанопора позволяет считывать всю последовательность (основание за основанием) перемещающейся через пору молекулы ДНК. Авторы считают, что графеновые нанопоры открывают новые, гораздо большие, чем только секвенирование ДНК, возможности. Они включают область разработки новых сенсоров для осуществления как фундаментальных, так и прикладных научных исследований (Liu A. et al., 2010).
et al., 2010).
В целом активно разрабатываемые новые биотехнологии секвенирования ДНК на основе использования нанобиотехнологических решений имеют широкие перспективы для применения в здравоохранении. Они могут позволить оптимизировать персонализированную диагностику, способствуя получению данных о предрасположенности к развитию сердечно-сосудистых заболеваний, рака, сахарного диабета и др.
Молекулярная визуализация — важнейшая диагностическая модальность, которая позволяет комбинировать лечебные и диагностические подходы и является базовой биотехнологией ПМ (Chen K., Chen X., 2010). Наночастицы в составе суперпарамагнитных контрастных соединений и перфлюороуглеродных нанокомпозиций используются в качестве инструмента для формирования молекулярного изображения, что позволяет проводить отбор пациентов для персонализированной терапии (Caruthers S.D. et al., 2006; Chen K., Chen X., 2010).
Развитие многофункциональных транспортных наноплатформ для наноассоциированной доставки визуализирующих меток оптимизирует такие современные молекулярные визуализирующие технологии, как оптическая когерентная томография, рентгеновская компьютерная томография, магнитно-резонансная томография, однофотонная компьютерная томография, позитронно-эмиссионная томография (Дынник О. Б., Залесский В.Н., 2005; Залесский В.Н., Дынник О.Б., 2005; Залесский В.Н., Дынник О.Б., 2006; Cai W., Chen X., 2007; Залесский В.Н., 2009).
Б., Залесский В.Н., 2005; Залесский В.Н., Дынник О.Б., 2005; Залесский В.Н., Дынник О.Б., 2006; Cai W., Chen X., 2007; Залесский В.Н., 2009).
Мишеньассоциированные лиганды, визуализирующие метки, наноплатформы и многие другие нанобиоконструкции позволяют проводить таргетную наномолекулярную персонализированную диагностику в условиях клиники (Залесский В.Н., 2009). Сравнительно недавно разработан метод молекулярной визуализации с использованием наночастиц золота для диагностики состояния уязвимости атеросклеротических бляшек коронарных артерий при использовании многоцветной компьютерной томографии. Данная инновация может способствовать проведению надежной персонализированной диагностики и лечения кардиальных событий у пациентов в клинических условиях (Lukianova-Hleb E.Y. et al., 2009).
Некоторые биоконструкции (нанобиосенсоры, нанобиочипы), создаваемые на основе современных наноматериалов, помогают в процессах создания и доставки новых лекарственных препаратов (Jain K.K., 2007; Marcato P. D., Durán N., 2008).
D., Durán N., 2008).
Доставка лекарственных соединений стала важнейшей стратегией современных нанофармакологических исследований (Marcato P.D., Durán N., 2008; Farokhzad O.C., Langer R., 2009). Таргетная доставка к целевому органу или ткани, а также преодоление биологических барьеров крайне важны для безопасного и эффективного использования лекарственных соединений. Конъюгаты наночастиц со специфическими лигандами и аптамерами дают возможность проводить специфическое таргетирование с высокой клинической эффективностью (Debbage P., 2009).
Нанобиотехнологии также вносят существенный вклад в проведение процедур клеточной и генной терапии, которые являются составными частями персонализированного лечения (Guo K.T. et al., 2008; Wolf S.M. et al., 2009).
Удачным примером доставки терапевтического материала в составе наноконструкций послужило создание наночастиц, начиненных малыми интерферирующими РНК (small interfering RNA — siRNA), что позволило им эффективно проникать внутрь раковых клеток и непосредственно индуцировать подавление экспрессии гена-мишени (Tian Z. еt al., 2010).
еt al., 2010).
Феномен РНК-интерференции, заключающийся в способности двухцепочечной молекулы siRNA прицельно блокировать синтез определенных белков, сегодня рассматривается в качестве перспективного подхода к разработке новых лекарственных препаратов (Corydon T.J., Mikkelsen J.G., 2006). Однако доставка терапевтических молекул siRNA в клетки-мишени оказалась довольно сложной задачей. После введения в организм siRNA быстро выводились почками, поэтому для обеспечения их эффективности потребовались нетоксические частицы-носители, способные доставлять содержимое в клетки-мишени, не вызывая при этом иммунного ответа.
Впервые осуществлено системное введение терапевтических siRNA, заключенных внутрь специальным образом сконструированных наночастиц, в клинических тестовых исследованиях для лечения больных макулярной дегенерацией сетчатки глаза и инфекционным поражением легких, вызванным респираторно- синцитиальным вирусом (Tiemann K., Rossi J.J., 2009; Tokatlian T., Segura T., 2010). Молекулярный маркер на поверхности таких наночастиц специфически связывается с рецепторами мембран злокачественных клеток и обеспечивает внутриклеточное проникновение siRNA.
Молекулярный маркер на поверхности таких наночастиц специфически связывается с рецепторами мембран злокачественных клеток и обеспечивает внутриклеточное проникновение siRNA.
Помещенные в наночастицы молекулы siRNA блокируют синтез рибонуклеотидредуктазы М2 (ribonucleotide reductase M2 — RRM2) — фермента, управляющего восстановлением повреждений ДНК. Выбор данного гена в качестве мишени (вернее, комплементарной ему информационной РНК-матрицы, на которой синтезируется собственно белок) был необходим для повышения вероятности положительного эффета терапии (гиперэкспрессия RRM2 отмечена именно в том регионе, на который прицельно воздействовали тестируемой siRNA (Tokatlian T., Segura T., 2010).
Персонализированная онкология
Нанобиотехнологии выполняют важную роль в персонализированных онкологических исследованиях. Они способствуют оптимизации процесса идентификации опухольассоциированных биомаркерных молекул, используемых в качестве основы для осуществления специфической молекулярной онкодиагностики и проведения таргетной терапии. Так, avβ3-таргетные парамагнитные наночастицы прошли успешную клиническую апробацию при их использовании в неинвазивной визуализации крайне малых очагов ангиогенеза, ассоциированных с растущей опухолевой (меланома кожи) тканью (Schmieder A.H. et al., 2005). Оказалось, что наночастицы, содержащие металлы переменной валентности, способствовали повышению контрастности изображения при магнитно-резонансном сканировании, формируя молекулярный формат изображения. Присоединенные к поверхности наночастиц белковые молекулы фиксировались к эндотелию новообразованных микрососудов, идентифицируя участки роста опухолевой ткани. Молекулярный формат изображения позволял зарегистрировать участки неоангиогенеза в зонах роста опухоли, по сравнению с остающимися «немыми» в анатомическом формате изображениями при проведении стандартной магнитно-резонансной томографии. Также раннее обнаружение роста опухоли повышало эффективность персонализированной терапии меланомы кожи.
Так, avβ3-таргетные парамагнитные наночастицы прошли успешную клиническую апробацию при их использовании в неинвазивной визуализации крайне малых очагов ангиогенеза, ассоциированных с растущей опухолевой (меланома кожи) тканью (Schmieder A.H. et al., 2005). Оказалось, что наночастицы, содержащие металлы переменной валентности, способствовали повышению контрастности изображения при магнитно-резонансном сканировании, формируя молекулярный формат изображения. Присоединенные к поверхности наночастиц белковые молекулы фиксировались к эндотелию новообразованных микрососудов, идентифицируя участки роста опухолевой ткани. Молекулярный формат изображения позволял зарегистрировать участки неоангиогенеза в зонах роста опухоли, по сравнению с остающимися «немыми» в анатомическом формате изображениями при проведении стандартной магнитно-резонансной томографии. Также раннее обнаружение роста опухоли повышало эффективность персонализированной терапии меланомы кожи.
Другим примером использования металлсодержащих наночастиц в онкологии может служить применение их в составе платформ-переносчиков высоких доз противоопухолевых антибиотиков в бластомную ткань (без развития признаков системной токсичности) (Upadhyay K. K. et al., 2009). Наночастицы для магнитно-резонансной томографической визуализации позволяют клиницисту быстрее оценить эффективность лечения по сравнению с использованием стандартной магнитно-резонансной томографии до и после терапевтических воздействий. В целом для персонализированной противоопухолевой терапии важнейшими являются следующие составляющие: раннее выявление процесса, комбинация диагностических и лечебных процедур, а также мониторирование эффективности лечения (Roukos D.H., 2009).
K. et al., 2009). Наночастицы для магнитно-резонансной томографической визуализации позволяют клиницисту быстрее оценить эффективность лечения по сравнению с использованием стандартной магнитно-резонансной томографии до и после терапевтических воздействий. В целом для персонализированной противоопухолевой терапии важнейшими являются следующие составляющие: раннее выявление процесса, комбинация диагностических и лечебных процедур, а также мониторирование эффективности лечения (Roukos D.H., 2009).
Дендримеры являются сравнительно новым классом 3D наноразмерных структур с довольно обширной областью применения в медицине, включая персонализированную онкологию, благодаря уникальным физико-химическим свойствам их поверхности (Baker J.R. Jr., 2009; Medina S.H., El-Sayed M.E., 2009). Они чаще стали использоваться для доставки лекарств наряду с применением в процессах синтеза новых фармакологических соединений. Известно, что поливалентные дендримеры взаимодействуют одновременно со многими лекарственными мишенями и могут быть использованы для создания новых таргетных противоопухолевых соединений (Medina S. H., El-Sayed M.E., 2009; Sajja H.K. et al., 2009).
H., El-Sayed M.E., 2009; Sajja H.K. et al., 2009).
Конъюгирование дендримеров с различными биологическими соединениями, в частности фолиевой кислотой, в сочетании с комплементарными ДНК- олигонуклеотидами, позволило создать «гроздевидные» молекулы для таргетирования опухолевых клеток, со сверхэкспрессированными на их поверхности высокоаффинными фолатными рецепторами (Choi Y. et al., 2005; Baker J.R. Jr., 2009).
Мультифункциональные и многокомпонентные наноструктуры интенсивно исследуются и способствуют оптимизации персонализированной противоопухолевой терапии (Cho K. et al., 2008; de Dios A.S., Diaz-Garcia M.E., 2010). Конъюгаты наночастиц с лигандами (моноклональными антителами, пептидами или малыми молекулами) применяются для таргетирования злокачественных новообразований с высокой специфичностью. Эти данные свидетельствуют о формировании нового направления — персонализированной онкологии (Wang M.D. et al., 2007; Stambuk K.S. et al., 2010; Roukos D.H., 2010).
Персонализированная кардиология
Будущее наномолекулярной диагностики сердечно-сосудистых заболеваний существенным образом зависит от развития мультифункциональных наносистем в качестве визуализирующих агентов (Залесский В. Н., 2009; Pan D. et al., 2010). Одновременно с этим постепенно расширяется сфера использования наноплатформ в кардиологии для доставки лекарственных препаратов (Wickline S.A. et al., 2006; Iverson N. et al., 2008). Параллельное применение перфлюороуглеродных наночастиц для таргетной доставки лекарств и с целью формирования молекулярного профиля изображения в области атеросклеротических поражений стенки коронарных сосудов существенно оптимизирует потенциал персонализированной кардиологии в целом (Lanza G.M. et al., 2006; Kaneda M.M. et al., 2009).
Н., 2009; Pan D. et al., 2010). Одновременно с этим постепенно расширяется сфера использования наноплатформ в кардиологии для доставки лекарственных препаратов (Wickline S.A. et al., 2006; Iverson N. et al., 2008). Параллельное применение перфлюороуглеродных наночастиц для таргетной доставки лекарств и с целью формирования молекулярного профиля изображения в области атеросклеротических поражений стенки коронарных сосудов существенно оптимизирует потенциал персонализированной кардиологии в целом (Lanza G.M. et al., 2006; Kaneda M.M. et al., 2009).
В результате развития персонализированной диагностики сердечно-сосудистых заболеваний совершенствование стратегий усиления индуцируемых сигналов в тканях на основе использования нанобиотехнологических инновационных решений привело к быстрому развитию современных визуализирующих систем (коронарной магнитно-резонансной томографии и оптической коронарной томографии, оптической когерентной томографии) сверхвысокого разрешения (Jaffer F.A., Weissleder R. , 2004; Залесский В.Н., Дынник О.Б., 2005; Залесский В.Н., 2009).
, 2004; Залесский В.Н., Дынник О.Б., 2005; Залесский В.Н., 2009).
В этом контексте молекулярная визуализация на основе применения наноконтрастных меток, корреспондирующих изображение молекул-мишеней (in vivo), может оказаться полезным инструментом исследования молекулярных звеньев патогенеза атеросклероза в рамках персонализированной диагностики, включая локальное воспаление, апоптоз и ангиогенез.
Структурная трансформация фиброзной покрышки атеросклеротической бляшки, сопровождающаяся высоким риском возникновения ее разрыва, может быть успешно отслежена с помощью метода магнитно-резонансной томографии, компьютерной томографии или внутрисосудистой ультразвуковой визуализации, что позволяет получать наиболее полную анатомическую характеристику бляшко-ассоциированной атеросклеротической поверхности венечного сосуда сердца. Однако лишь молекулярная визуализация позволяет уточнить степень активности альтеративных процессов на атерогенной поверхности венечных сосудов и обосновать реальный прогноз возможного развития осложнений атеросклероза, что оптимизирует процесс персонализированной диагностики в кардиологии (Залесский В. Н., 2009).
Н., 2009).
Подробно изучен процесс активизации макрофагов, выступающих в качестве клеточных эффекторов воспаления, а их присутствие расценивается как предиктор высокого риска возникновения уязвимости атеросклеротической бляшки (Naghavi M. et al., 2003). Установлено, что магнитные наночастицы (окись железа) связываются с макрофагами атеросклеротически измененной сосудистой стенки и преимущественно накапливаются в бляшках a. carotis (Kooi M.E. et al., 2003; Trivedi R.A. et al., 2004). В этих двух независимых исследованиях выполненное магнитно-резонансное сканирование на фоне введения наночастиц, при проведении каротидной эндартерэктомии, позволило визуализировать очаги локального воспаления в пределах атеросклеротической бляшки. Более тонкие механизмы атеросклеротического процесса были раскрыты при использовании методики наноассоциированной магнитофлюоресценции. Необходимо отметить, что оптимизация молекулярного профиля изображения кардиоваскулярных структур и адресной доставки лекарств на основе использования нанобиотехнологий позволит сегодня значительно ускорить развитие персонализированной кардиологии будущего (Ginsburg G. S. et al., 2005; Schoenhagen P., Conyers J.L., 2008; Lee S.H. et al., 2009).
S. et al., 2005; Schoenhagen P., Conyers J.L., 2008; Lee S.H. et al., 2009).
Заключение
На протяжении уже ближайших нескольких лет могут возникнуть и получат стремительное развитие ряд новых направлений персонализированной диагностики и терапии в условиях работы специализированных клиник и центров ПМ (Corsi F., Prosperi D., 2010). Это позволит повысить интерес практических врачей к молекулярным звеньям патогенеза заболеваний, а также методам наномолекулярной диагностики и терапии. Значительный прогресс следует ожидать в создании мультимодальных наносоединений, повышающих контрастность молекулярного изображения, а также новых технических средств и алгоритмов оптимизации визуализации молекулярных процессов в наношкальном формате с помощью современных биоконструкций. Это создает предпосылки для базовой инфраструктуры и повысит эффективность методов ПМ в целом.
Принимая во внимание наблюдаемый в последние годы процесс развития высокоспециализированных, высокоточных и наукоемких нанобиотехнологий для решения лечебно-профилактических и диагностических задач практически во всех областях медицины, не вызывает сомнений дальнейший интенсивный рост их использования в широкой клинической практике.![]() Все это свидетельствует о назревшей необходимости организации Национального научного центра персонализированной медицины с одновременным созданием сети специализированных научно-исследовательских институтов по проблемам геномики, протеомики, метаболомики, транскриптомики, цитомики, а также наномолекулярной визуализации для диагностики и терапии заболеваний человека, при государственной поддержке со стороны НАН Украины, НАМН Украины и Министерства здравоохранения Украины с участием частных инвесторов в целях координации и планирования данного направления исследований в нашей стране.
Все это свидетельствует о назревшей необходимости организации Национального научного центра персонализированной медицины с одновременным созданием сети специализированных научно-исследовательских институтов по проблемам геномики, протеомики, метаболомики, транскриптомики, цитомики, а также наномолекулярной визуализации для диагностики и терапии заболеваний человека, при государственной поддержке со стороны НАН Украины, НАМН Украины и Министерства здравоохранения Украины с участием частных инвесторов в целях координации и планирования данного направления исследований в нашей стране.
Литература
- Дынник О.Б., Залесский В.Н. (2005) Внутрикоронарная ультразвуковая томографическая визуализация (проблемы и перспективы). Укр. мед. часопис, 5(49): 89–94.
- Залесский В.Н. (2009) Наномолекулярная медицина: современные биотехнологии наномолекулярной диагностики, лучевые томографические методы визуализации, наномодифицированная клеточная и лекарственная терапия.
 ВИПОЛ, Київ, 320 с.
ВИПОЛ, Київ, 320 с. - Залесский В.Н., Дынник О.Б. (2005) Внутрисосудистая оптическая когерентная томография: возможности визуализации коронарной патологии. Укр. мед. часопис, 6(50): 42–46.
- Залесский В.Н., Дынник О.Б. (2006) Визуализация кальциноза методом спиральной компьютерно-томографической коронароангиографии. Укр. мед. часопис, 3(53): 78–83.
- Розенфельд Л.Г., Москаленко В.Ф., Чекман І.С., Мовчан Б.О. (2008) Нанотехнології, наномедицина: перспективі наукових досліджень та впровадження їх результатів у медичну практику. Укр. мед. часопис, 5(67): 63–68.
- Archakov A.I., Ivanov Y.D. (2007) Analytical nanobiotechnology for medicine diagnostics. Mol. Biosyst., 3(5): 336–342.
- Baker J.R. Jr. (2009) Dendrimer-based nanoparticles for cancer therapy. Hematology Am. Soc. Hematol. Educ. Program, 708–719.
- Cai W., Chen X. (2007) Nanoplatforms for targeted molecular imaging in living subjects.
 Small, 3(11): 1840–1854.
Small, 3(11): 1840–1854. - Caruthers S.D., Winter P.M., Wickline S.A., Lanza G.M. (2006) Targeted magnetic resonance imaging contrast agents. Methods Mol. Med., 124: 387–400.
- Chen K., Chen X. (2010) Design and development of molecular imaging probes. Curr. Top. Med. Chem., 10(12): 1227–1236.
- Cho K., Wang X., Nie S. et al. (2008) Therapeutic nanoparticles for drug delivery in cancer. Clin. Cancer Res., 14(5): 1310–1316.
- Choi Y., Thomas T., Kotlyar A. et al. (2005) Synthesis and functional evaluation of DNA-assembled polyamidoamine dendrimer clusters for cancer cell-specific targeting. Chem. Biol., 12(1): 35–43.
- Corsi F., Prosperi D. (2010) Molecular nanoclinics: Dream or reality? Pharmacol. Res., 62(2): 55–56.
- Corydon T.J., Mikkelsen J.G. (2006) RNA interference — towards individualized genetic medicine. Ugeskr. Laeger, 168(50): 4401–4404.

- Davies K. (2010) The $1,000 Genome: The Revolution in DNA Sequencing and the New Era of Personalized Medicine. FREE PRESS, New York, 340 p.
- de Dios A.S., Díaz-García M.E. (2010) Multifunctional nanoparticles: analytical prospects. Anal. Chim. Acta, 666(1–2): 1–22.
- Debbage P. (2009) Targeted drugs and nanomedicine: present and future. Curr. Pharm. Des., 15(2): 153–172.
- Derfus A.M., Chen A.A., Min D.H. et al. (2007) Targeted quantum dot conjugates for siRNA delivery. Bioconjug Chem., 18(5): 1391–1396.
- Farokhzad O.C., Langer R. (2009) Impact of nanotechnology on drug delivery. ACS Nano, 3(1): 16–20.
- Geho D.H., Jones C.D., Petricoin E.F., Liotta L.A. (2006) Nanoparticles: potential biomarker harvesters. Curr. Opin. Chem. Biol., 10(1): 56–61.
- Ginsburg G.S., Donahue M.P., Newby L.K. (2005) Prospects for personalized cardiovascular medicine: the impact of genomics.
 J. Am. Coll. Cardiol., 46(9): 1615–1627.
J. Am. Coll. Cardiol., 46(9): 1615–1627. - Guo K.T., Ziemer G., Paul A., Wendel H.P. (2008) CELL-SELEX: Novel perspectives of aptamer-based therapeutics. Int. J. Mol. Sci., 9(4): 668–678.
- Hess H., Jaeger L. (2010) Nanobiotechnology. Curr. Opin. Biotechnol., 21(4): 373–375.
- Iverson N., Plourde N., Chnari E. et al. (2008) Convergence of nanotechnology and cardiovascular medicine: progress and emerging prospects. BioDrugs, 22(1): 1–10.
- Jaffer F.A., Weissleder R. (2004) Seeing within: molecular imaging of the cardiovascular system. Circ. Res., 94(4): 433–445.
- Jain K.K. (2007) Applications of nanobiotechnology in clinical diagnostics. Clin. Chem., 53(11): 2002–2009.
- Jain K.K. (2009a) Textbook of Personalized Medicine. Springer, New York, 419 p.
- Jain K.K. (2009b) The role of nanobiotechnology in drug discovery.
 Adv. Exp. Med. Biol., 655: 37–43.
Adv. Exp. Med. Biol., 655: 37–43. - Kaneda M.M., Caruthers S., Lanza G.M., Wickline S.A. (2009) Perfluorocarbon nanoemulsions for quantitative molecular imaging and targeted therapeutics. Ann. Biomed. Eng., 37(10): 1922–1933.
- Kooi M.E., Cappendijk V.C., Cleutjens K.B. et al. (2003) Accumulation of ultrasmall superparamagnetic particles of iron oxide in human atherosclerotic plaques can be detected by in vivo magnetic resonance imaging. Circulation, 107(19): 2453–2458.
- Lanza G.M., Winter P.M., Caruthers S.D. et al. (2006) Nanomedicine opportunities for cardiovascular disease with perfluorocarbon nanoparticles. Nanomedicine (Lond, 1(3): 321–329.
- Lee J., Choi Y., Kim K. et al. (2010) Characterization and cancer cell specific binding properties of anti-EGFR antibody conjugated quantum dots. Bioconjug Chem., 21(5): 940–946.
- Lee S.H., Shin D.J., Jang Y. (2009) Personalized medicine in coronary artery disease: insights from genomic research.
 Korean Circ. J., 39(4): 129–137.
Korean Circ. J., 39(4): 129–137. - Lesniak W., Bielinska A.U., Sun K. (2005) Silver/dendrimer nanocomposites as biomarkers: fabrication, characterization, in vitro toxicity, and intracellular detection. Nano Lett., 5(11): 2123–2130.
- Liu A., Zhao Q., Guan X. (2010) Stochastic nanopore sensors for the detection of terrorist agents: current status and challenges. Anal. Chim. Acta, 675(2): 106–115.
- Lukianova-Hleb E.Y., Mrochek A.G., Lapotko D.O. (2009) Method for disruption and re-canalization of atherosclerotic plaques in coronary vessels with photothermal bubbles generated around gold nanoparticles. Lasers Surg. Med., 41(3): 240–247.
- Mahmoud W., Sukhanova A., Oleinikov V. et al. (2010) Emerging applications of fluorescent nanocrystals quantum dots for micrometastases detection. Proteomics., 10(4): 700–716.
- Marcato P.D., Durán N. (2008) New aspects of nanopharmaceutical delivery systems.
 J. Nanosci. Nanotechnol., 8(5): 2216–2229.
J. Nanosci. Nanotechnol., 8(5): 2216–2229. - Medina S.H., El-Sayed M.E. (2009) Dendrimers as carriers for delivery of chemotherapeutic agents. Chem. Rev., 109(7): 3141–3157.
- Mirsaidov U.M., Wang D., Timp W., Timp G. (2010) Molecular diagnostics for personal medicine using a nanopore. Wiley Interdiscip. Rev. Nanomed. Nanobiotechnol., 2(4): 367–381.
- Naghavi M., Libby P., Falk E. et al. (2003) From vulnerable plaque to vulnerable patient: a call for new definitions and risk assessment strategies: Part I. Circulation, 108(14): 1664–1672.
- Nordström A., Lewensohn R. (2010) Metabolomics: moving to the clinic. J. Neuroimmune Pharmacol., 5(1): 4–17.
- Pan D., Caruthers S.D., Chen J. et al. (2010) Nanomedicine strategies for molecular targets with MRI and optical imaging. Future Med. Chem., 2(3): 471–490.
- Pettersson E., Lundeberg J., Ahmadian A. (2009) Generations of sequencing technologies.
 Genomics, 93(2): 105–111.
Genomics, 93(2): 105–111. - Roukos D.H. (2009) Personalized cancer diagnostics and therapeutics. Expert. Rev. Mol. Diagn., 9(3): 227–229.
- Roukos D.H. (2010) Systems medicine: a real approach for future personalized oncology? Pharmacogenomics, 11(3): 283–287.
- Saito M., Yoshino T. (2010) Clinical development of biomarkers for personalized medicine. Nippon Rinsho, 68(6): 1111–1116.
- Sajja H.K., East M.P., Mao H. et al. (2009) Development of multifunctional nanoparticles for targeted drug delivery and noninvasive imaging of therapeutic effect. Curr. Drug Discov. Technol., 6(1): 43–51.
- Schmieder A.H., Winter P.M., Caruthers S.D. et al. (2005) Molecular MR imaging of melanoma angiogenesis with alphanubeta3-targeted paramagnetic nanoparticles. Magn. Reson. Med., 53(3): 621–627.
- Schneider G.F., Kowalczyk S.W., Calado V.E. et al. (2010) DNA translocation through graphene nanopores.
 Nano Lett., 10(8): 3163-3167.
Nano Lett., 10(8): 3163-3167. - Schoenhagen P., Conyers J.L. (2008) Nanotechnology and atherosclerosis imaging: emerging diagnostic and therapeutic applications. Recent Pat. Cardiovasc. Drug Discov., 3(2): 98–104.
- Sharon D., Chen R., Snyder M. (2010) Systems biology approaches to disease marker discovery. Dis. Markers, 28(4): 209–224.
- Stambuk S., Sundov D., Kuret S. et al. (2010) Future perspectives of personalized oncology. Coll. Antropol., 34(2): 763–769.
- Stofik M., Strýhal Z., Malý J. (2009) Dendrimer-encapsulated silver nanoparticles as a novel electrochemical label for sensitive immunosensors. Biosens. Bioelectron, 24(7): 1918–1923.
- Tian Z., Wang H., Jia Z. et al. (2010) Tumor-Targeted Inhibition by a Novel Strategy — Mimoretrovirus Expressing siRNA Targeting the Pokemon Gene. Curr. Cancer Drug Targets, 10(8): 932–941.
- Tiemann K., Rossi J.
 J. (2009) RNAi-based therapeutics-current status, challenges and prospects. EMBO Mol. Med., 1(3): 142–151.
J. (2009) RNAi-based therapeutics-current status, challenges and prospects. EMBO Mol. Med., 1(3): 142–151. - Tokatlian T., Segura T. (2010) siRNA applications in nanomedicine. Wiley Interdiscip. Rev. Nanomed. Nanobiotechnol., 2(3): 305–315.
- Trent R.J. (2010) Pathology practice and pharmacogenomics. Pharmacogenomics, 11(1): 105–111.
- Trivedi R.A., U-King-Im J.M., Graves M.J. et al. (2004) In vivo detection of macrophages in human carotid atheroma: temporal dependence of ultrasmall superparamagnetic particles of iron oxide-enhanced MRI. Stroke, 35(7): 1631–1635.
- Upadhyay K.K., Agrawal H.G., Upadhyay C. et al. (2009) Role of block copolymer nanoconstructs in cancer therapy. Crit. Rev. Ther. Drug Carrier Syst., 26(2): 157–205.
- Wang M.D., Shin D.M., Simons J.W., Nie S. (2007) Nanotechnology for targeted cancer therapy. Expert Rev. Anticancer Ther., 7(6): 833–837.

- Wickline S.A., Neubauer A.M., Winter P. et al. (2006) Applications of nanotechnology to atherosclerosis, thrombosis, and vascular biology. Arterioscler. Thromb. Vasc. Biol., 26(3): 435–441.
- Willard H.F., Ginsburg G.S. (Eds) (2008) Genomic and Personalized Medicine. Academic Press, 1558 p.
- Wolf S.M., Gupta R., Kohlhepp P. (2009) Gene therapy oversight: lessons for nanobiotechnology. J. Law Med. Ethics., 37(4): 659–684.
- Xu M., Fujita D., Hanagata N. (2009) Perspectives and challenges of emerging single-molecule DNA sequencing technologies. Small, 5(23): 2638–2649.
- Zhou S.F., Di Y.M., Chan E. et al. (2008) Clinical pharmacogenetics and potential application in personalized medicine. Curr. Drug Metab., 9(8): 738–784.
В.М. Залеський, Б.О. Мовчан
Резюме. Огляд присвячений обговоренню перспективних напрямів персоналізованої діагностики і терапії в кардіології та онкології при використанні інноваційних нанобіотехнологій. Наведено результати основних досліджень з цього питання.
Наведено результати основних досліджень з цього питання.
Ключові слова: персоналізована медицина, нанобіотехнології, кардіологія, онкологія.
V.N. Zalessky, B.A. Movchan
Summary. Perspective diagnostic and therapeutic methods of the personalized medicine in cardiology and oncology with used of innovation nanobiotechnology are examineted in the review. The results of the principal trials regarding this question are provided.
Key words: personalized medicine, nanobiotechnology, cardiology, oncology.
Адрес для переписки:
Залесский Вячеслав Николаевич
03151, Киев, ул. Народного ополчения, 5
Национальный научный центр «Институт кардиологии имени Н.Д. Стражеско» НАМН Украины
Персональная медицина. Редакция «Чердака» разобралась в том, что же такое персонализированная медицина
— Что такое персонализированная медицина?— Это понятие включает в себя несколько аспектов. Во-первых, это индивидуальный подбор препаратов с учетом индивидуальных особенностей организма. Классический пример: в развитых странах проводится специальный генетический тест, который определяет скорость метаболизма. Например, многие выходцы из Африки должны получать меньшую дозу некоторых лекарств, потому что у них менее активный, чем у европейцев, метаболизм. Это пример персонализации на уровне расы, есть и более тонкая. Есть другие аспекты персонализированной медицины.
Во-первых, это индивидуальный подбор препаратов с учетом индивидуальных особенностей организма. Классический пример: в развитых странах проводится специальный генетический тест, который определяет скорость метаболизма. Например, многие выходцы из Африки должны получать меньшую дозу некоторых лекарств, потому что у них менее активный, чем у европейцев, метаболизм. Это пример персонализации на уровне расы, есть и более тонкая. Есть другие аспекты персонализированной медицины.
— Предрасположенности к болезням?
— Не только. Можно, например, предсказывать спортивные успехи. Есть варианты генов, при которых человек, скорее всего, не станет олимпийским чемпионом по велоспорту, а вот здоровье на тренировках он погубит. Хотя другой спортсмен в тех же условиях превратится в чемпиона мира.
Еще персонализация включает клеточные технологии, когда, к примеру, вакцину от рака делают на основе клеток самого пациента. И, наконец, это персонализированные методы диагностики и прогнозирования, сделанные под конкретного пациента.
— Насколько реально создать биосенсор, который сможет ставить диагноз не по крови из вены или с использованием биопсийного материала, а каким-нибудь более удобным и безболезненным способом? Например, по выдыхаемому воздуху?
— Вообще, анализировать воздух гораздо сложнее, чем жидкости.
— Потому что надо отличить молекулы, попавшие из ткани легкого, от молекул недавно съеденной шавермы?
— Да, именно. Там пыль, чешуйки кожи. Однако у ученых есть идеи, что можно сделать. Можно взять фильтр, попросить человека в него подышать, потом собрать весь материал и прицельно провести ПЦР (полимеразная цепная реакция, поиск заданной последовательности нуклеотидов ДНК; с ее помощью можно, например, искать фрагменты геномов раковых клеток — прим. «Чердака»).
— И тогда мы не спутаем клетки человека с волосками кота?
— Нет, не спутаем, мы будем прицельно искать раковый геном, ни у какого червячка или кота Барсика такого нет. Но, подчеркну, это пока все на уровне идей. Сейчас в диагностике рака намечена такая тема, она в процессе разработки. Есть пока только диагностика рака прямой и толстой кишки по анализу кала, в котором ищется заданная ДНК, этот метод прошел первые клинические испытания. А кал — это очень грязная во всех отношениях субстанция, там множество разных бактерий со своей ДНК.
Сейчас в диагностике рака намечена такая тема, она в процессе разработки. Есть пока только диагностика рака прямой и толстой кишки по анализу кала, в котором ищется заданная ДНК, этот метод прошел первые клинические испытания. А кал — это очень грязная во всех отношениях субстанция, там множество разных бактерий со своей ДНК.
— А что вообще можно диагностировать при помощи ДНК?
— Можно диагностировать наследственные заболевания и рак, предсказывать спортивные достижения, определять переносимость и эффективность лекарств, например, варфарина. Можно проводить метагеномный анализ (метагеномом называют совокупность геномов бактерий-симбионтов, кишечной микрофлоры — прим. «Чердака») и даже подбирать диету. Впрочем, подбор диеты и выявление предрасположенностей к болезням существуют пока на уровне общих рекомендаций по профилактике.
О диагностике в целом. Насколько достоверны тесты ДНК, которые можно купить по почте?
— Эти рекомендации как-то отличаются от банального «вам не надо курить, поскольку это вызывает рак»?
— С предрасположенностью есть другая проблема. Предположим, у вас есть пять тысяч больных людей и пять тысяч здоровых. В группе здоровых у одного человека в определенном месте ДНК находится «буква» A, а в группе больных «буква» А в этом месте встречается уже у 50 человек. Кажется, это большая разница, но клиническая значимость ее ограничена: несмотря на то, что у больных «буква» А встречается в 50 раз чаще, на деле у 99 процентов людей из этой группы в том самом месте ДНК другая «буква», не А. То есть, несмотря на разницу, нельзя сказать, что наличие А в этом месте однозначно позволяет выявить болезнь.
У двух людей может быть почти одинаковая ДНК, но в одном месте у первой пациентки окажется один нуклеотид, а у второй — другой. Иллюстрация: David Eccles / Wikimedia— Сегодня на рынке есть компании, которые утверждают, что занимаются персонализированной медициной. Они высылают клиентам набор для взятия пробы ДНК, анализируют присланные образцы и сообщают: «У вас вероятность такого-то заболевания повышена на столько-то процентов». Выходит, то, что они делают, бесполезно?
Они высылают клиентам набор для взятия пробы ДНК, анализируют присланные образцы и сообщают: «У вас вероятность такого-то заболевания повышена на столько-то процентов». Выходит, то, что они делают, бесполезно?
— Отнюдь. Пусть это не абсолютно достоверная и медицинская информация, но это интересно. Здесь та же история, что и, например, со смартфонами: эти устройства бесполезны для выживания, мой дедушка прожил 85 лет, у него не было смартфона, но он жил насыщенной и полноценной жизнью. Однако с гаджетами наша жизнь интереснее, поэтому я бы не стал выдавать производителей таких тестов за шарлатанов в одном ряду с гадалками и ясновидящими.
— А какова вообще точность разных видов молекулярной диагностики?
— Точность может достигать 99%. Но тем не менее тест, который дает такие результаты, может быть непригоден для поиска рака на ранней стадии у всего населения.
— Почему?
— Предположим, у нас есть миллион человек. Пусть рак будет у тысячи — он обычно примерно с такой частотой и встречается. Тест имеет точность 99%: вроде бы это очень неплохо, и разработчики такой методики опубликуют статью в хорошем журнале. При такой точности из тысячи реально больных врачи правильно найдут рак у 990 человек. Но сколько здоровых ошибочно получат предварительный диагноз «рак», если массово использовать этот тест? При точности 99 процентов это будет один человек из ста. Вычитаем из миллиона людей тысячу больных, остается 999 тысяч здоровых. Если каждому сотому придет ложноположительный ответ, мы получим 9900 ошибок.
Тест имеет точность 99%: вроде бы это очень неплохо, и разработчики такой методики опубликуют статью в хорошем журнале. При такой точности из тысячи реально больных врачи правильно найдут рак у 990 человек. Но сколько здоровых ошибочно получат предварительный диагноз «рак», если массово использовать этот тест? При точности 99 процентов это будет один человек из ста. Вычитаем из миллиона людей тысячу больных, остается 999 тысяч здоровых. Если каждому сотому придет ложноположительный ответ, мы получим 9900 ошибок.
Другими словами, лишь один из десяти, получивших такой предварительный диагноз, реально болен. Остальным придется зря делать болезненную и дорогую биопсию, а также слышать страшное «у вас, вероятно, рак». Кто-то, услышав такое, и повеситься может. Страховые компании тоже будут очень недовольны счетами за лишние диагностические процедуры.
Для традиционной диагностики рака часто требуется взять пробу ткани, что сопряжено с не самыми простыми, безопасными и безболезненными процедурами. Иллюстрация: John Doe / Wikimedia
Иллюстрация: John Doe / WikimediaО раке
— А почему о раковом геноме Вы говорите отдельно? Как будто это не геном человека с болезнью, а нечто особенное?
— Дело в том, что раковые клетки в некотором смысле не человеческие. Любой рак — это результат мутации в клетках, и мы стремимся к тому, чтобы в каждом случае узнать, где эти мутации произошли. Мутантные клетки уже отличаются на уровне ДНК от окружающих, и потому их можно найти. Другое дело, что они постоянно меняются, появляются новые мутации, и в целом рак ведет себя как бактериальная инфекция, эволюционирует и выживает за счет повышенной способности к мутагенезу.
— Поэтому иммунная система не может с ними справиться?
— Да. Иммунная система и лекарства. Есть хорошие препараты, которые могут перебить большую часть клеток, но какая-то часть выживает и дает рецидивы. Хорошо, что лекарство работает, но плохо, что через некоторое время, порядка года, болезнь возвращается.
— А вакцина от рака существует?
— Да, есть вакцинные препараты, причем многие из них — это именно достижения персонализированной медицины. Их делают на основе собственных клеток пациента, «натаскивают» лимфоциты на клетки опухоли. Производство таких лекарств очень дорого, и, к сожалению, они работает лишь в малой части случаев: 1-3 процента, в зависимости от типа опухоли. Поэтому широкого применения такие вакцины пока не имеют. Хорошо было бы уметь предсказывать, выбирать тех людей, для которых вакцинация может оказаться эффективной.
Их делают на основе собственных клеток пациента, «натаскивают» лимфоциты на клетки опухоли. Производство таких лекарств очень дорого, и, к сожалению, они работает лишь в малой части случаев: 1-3 процента, в зависимости от типа опухоли. Поэтому широкого применения такие вакцины пока не имеют. Хорошо было бы уметь предсказывать, выбирать тех людей, для которых вакцинация может оказаться эффективной.
— Почему вы решили заниматься такими дорогостоящими и сложными исследованиями именно в России, а не, например, в США?
— В США проще с реактивами и оборудованием, у нас все это дороже. У нас есть проблемы с реформированием академических институтов: мы унаследовали систему, которая если и была эффективна, то в далеком прошлом. Даже если руководить реформой науки будет гений уровня Ландау, не факт, что он найдет решение всех проблем. Их очень много, и они сильно усложняют работу. Но, тем не менее, я не уезжаю — наверно потому, что привык тут работать. Я здесь командую группой, есть молодые и талантливые люди. Им бы денег подбросить только.
Им бы денег подбросить только.
— А откуда к вам приходят студенты?
— Я сам профессор Второго Меда, РНИМУ имени Н.И. Пирогова, медико-биологического факультета. С биофака МГУ к нам приходят, из Физтеха, они классные. Физтехи для такой работы подходят, в принципе, но они только, черти, биологию презирают (смеется).
Алексей Тимошенко
Что такое персонализированная медицина?
Ускорение открытий в лаборатории Джексона
Узнайте больше о том, как наши ученые ускоряют открытия, чтобы найти более эффективные, точные и персонализированные способы лечения, профилактики и лечения таких заболеваний, как рак.
Что такое точная или персонализированная медицина?
Купил бы мальчик-подросток такую же одежду, что и его бабушка? Возможно нет.Но когда они заболеют, они, скорее всего, получат такое же лечение, несмотря на их многочисленные различия. И все остальные тоже.
Это потому, что даже лучшие ученые и врачи мира еще не до конца понимают, как разные люди заболевают и реагируют на лечение. Результатом является универсальный подход к медицине, основанный на средних показателях населения. Эта традиционная практика часто не попадает в цель, потому что генетический состав каждого человека немного отличается от другого, часто в очень важных аспектах, влияющих на здоровье.
Появление точной медицины приближает нас к более точным, предсказуемым и мощным медицинским услугам, адаптированным для каждого пациента. Наше растущее понимание генетики и геномики — и того, как они влияют на здоровье, болезни и реакцию на лекарства у каждого человека — позволяет врачам обеспечивать более эффективную профилактику заболеваний, более точные диагнозы, более безопасные рецепты на лекарства и более эффективное лечение многих болезней и состояний, которые уменьшаются. наше здоровье.
наше здоровье.
Адаптация здравоохранения к уникальному генетическому типу каждого человека — это многообещающая идея, лежащая в основе точной медицины, также известной как индивидуализированная медицина, персонализированная медицина или геномная медицина.
Каковы преимущества точной медицины?
На протяжении всей истории практика медицины в значительной степени была реактивной. Даже сегодня мы обычно должны дождаться начала болезней, а затем попытаться вылечить или вылечить их. А поскольку мы не до конца понимаем генетические факторы и факторы окружающей среды, вызывающие серьезные заболевания, такие как рак, болезнь Альцгеймера и диабет, наши усилия по лечению этих заболеваний часто неточны, непредсказуемы и неэффективны.
Лекарства и методы лечения, которые мы разрабатываем, тестируются на широких слоях населения и назначаются с использованием средних статистических показателей.Следовательно, они работают для некоторых пациентов, но не для многих других из-за генетических различий среди населения. В среднем любое лекарство, отпускаемое по рецепту, сейчас на рынке работает только для половины тех, кто его принимает.
В среднем любое лекарство, отпускаемое по рецепту, сейчас на рынке работает только для половины тех, кто его принимает.
Персонализированная медицина, поскольку она основана на уникальном генетическом составе каждого пациента, начинает преодолевать ограничения традиционной медицины. Все чаще медицинские работники могут:
- Смещение акцента в медицине с реакции на профилактику
- прогнозирует восприимчивость к болезням
- улучшить обнаружение болезней
- Упреждать прогрессирование болезни
- настроить стратегии профилактики заболеваний
- назначают более эффективные препараты
- Избегайте назначения препаратов с предсказуемыми побочными эффектами
- сократить время, стоимость и количество отказов фармацевтических клинических испытаний
- устраняет неэффективность методом проб и ошибок, которая увеличивает расходы на здравоохранение и подрывает уход за пациентами.

Как JAX соединяет генетику с медицинской практикой?
Взаимодействие между сотнями генов и генных сетей, наряду с внешними факторами, такими как диета и упражнения, определяют наши биологические характеристики — например, цвет волос или уровень холестерина — и состояние нашего здоровья. Системная генетика — это комплексный подход к изучению и пониманию этой биологической сложности.
Разработка обширных баз данных с помощью мощных статистических инструментов, генетики, математики, физики и компьютерные ученые позволяют по-новому взглянуть на то, как генетическая сложность влияет на здоровье и болезни.
Лаборатория Джексона обладает глубокими знаниями в области системной генетики, что дает нам явное преимущество в поисках понимания болезней. Эта способность также приближает нас к персонализированной медицине, ориентированной на уникальный генетический состав каждого человека.
Наше исследование помогло объяснить, почему некоторые пациенты не ответили должным образом на Гливек, эффективное лекарство от некоторых форм лейкемии. Он также определил дополнительный препарат, который можно использовать с Гливеком, чтобы потенциально помочь этим пациентам.
Он также определил дополнительный препарат, который можно использовать с Гливеком, чтобы потенциально помочь этим пациентам.
Наша группа по системной генетике составляет карту десятков генетических взаимодействий, которые вызывают диабет 1 типа. Другие расшифровывают генную сеть, которая контролирует уровень ЛПВП, «хорошего» холестерина в нашей крови. А исследователи нашего Центра старения распутывают паутину генетических факторов и факторов окружающей среды, которые заставляют нас стареть.
Мы также храним и поддерживаем базу данных информатики генома мышей, самую полную в мире коллекцию генетических данных мышей. Этот глобальный ресурс необходим для понимания генетической сложности не только мышей, но и людей, которые на 95-98% генетически похожи на мышей.
Персонализированная медицина: биологический подход к лечению пациентов
Разговор с Иссамом Зинехом, директором отдела клинической фармакологии CDER
Как CDER / FDA определяет персонализированную медицину?
Персонализированная медицина имеет довольно широкое определение, но, по сути, мы говорим об использовании генетической или другой информации о биомаркерах для принятия решений о лечении пациентов. Сюда могут входить решения о том, кто должен получать определенные виды лечения или конкретные дозы данной терапии, или за кем следует более тщательно наблюдать, поскольку они предрасположены к определенной проблеме безопасности. Термины генетика, фармакогенетика, персонализированная медицина и фармакогеномика использовались как синонимы для обозначения изучения генетических вариаций и их влияния на то, как люди реагируют на лекарства.
Сюда могут входить решения о том, кто должен получать определенные виды лечения или конкретные дозы данной терапии, или за кем следует более тщательно наблюдать, поскольку они предрасположены к определенной проблеме безопасности. Термины генетика, фармакогенетика, персонализированная медицина и фармакогеномика использовались как синонимы для обозначения изучения генетических вариаций и их влияния на то, как люди реагируют на лекарства.
Опишите участие CDER в этой области.
За последнее десятилетие CDER активно размышлял о персонализированной медицине с точки зрения разработки лекарств и принятия регулирующих решений.Еще в начале 2000-х, когда проект генома человека подходил к завершению, мы имели представление о степени генетической изменчивости в геноме человека. Старшие руководители Управления клинической фармакологии и Центра сформулировали видение интеграции геномных наук в регуляторный обзор и разработку лекарств. Мы начали публиковать материалы по этой теме еще в 2001 году и продолжали это делать на протяжении многих лет.
CDER занимается разработкой инфраструктурных программ и анализом возможностей, чтобы быть на переднем крае инициатив в области персонализированной медицины.Совсем недавно мы работали с другими центрами FDA, чтобы обеспечить своевременную разработку информативных и прагматических рекомендаций и политик в отношении персонализированной медицины.
Как это работает?
Думаю, работает хорошо. Проблема заключалась в том, что в персонализированной медицине есть много движущихся частей.
Персонализированная медицина обычно состоит из двух элементов. Один из них — это лекарственное, биологическое или другое терапевтическое вмешательство, а второй — диагностический тест.Нам нужно было разработать не только политику CDER, но и многоцентровую политику в области персонализированной медицины, в которую вовлечены Центр устройств и радиологического здоровья (CDRH), Центр оценки и исследований биологических препаратов и другие центры FDA. На мой взгляд, было довольно сложно координировать это взаимодействие примерно с 2008 по 2011 год, главным образом потому, что центры физически не были расположены рядом друг с другом.
Теперь, когда CDER и CDRH находятся в одном кампусе, между центрами произошло гораздо более тесное взаимодействие в плане совместной разработки руководств и обмена опытом и процессами регулятивной проверки.Я считаю прошедший год или около того успешным, и, продвигаясь вперед, теперь будет намного легче координировать свои действия, поскольку мы стали ближе и больше осознаем необходимость совместной работы для создания некоторых из этих важных рабочих продуктов.
Был ли у вас кто-нибудь, кто говорил: «Нет, это не лучший способ», или у вас были какие-либо разногласия по поводу этой области?
Отличный вопрос. С точки зрения отрасли, персонализированная медицина была многообещающей. Идея о том, что вы можете определить подгруппы пациентов, которые с большей вероятностью ответят на определенное лечение, была очень привлекательной.Многие компании искали тот факт, что вы можете идентифицировать этих пациентов с помощью биомаркера.
Я думаю, люди чувствовали, что не было большого успеха за пределами области онкологии. Тем не менее, несколько недавних разрешений на лекарства в других терапевтических областях были примечательны своими персонализированными медицинскими качествами. Например, недавно мы получили одобрение нового препарата для лечения муковисцидоза и активности в нескольких других терапевтических областях, что свидетельствует о том, что теперь наука может быть более широко применена к областям за пределами гематологии и онкологии.
Тем не менее, несколько недавних разрешений на лекарства в других терапевтических областях были примечательны своими персонализированными медицинскими качествами. Например, недавно мы получили одобрение нового препарата для лечения муковисцидоза и активности в нескольких других терапевтических областях, что свидетельствует о том, что теперь наука может быть более широко применена к областям за пределами гематологии и онкологии.
Люди не спорят с идеей, что вы можете улучшить свое понимание соотношения риска и пользы с помощью персонализированной медицины. Главный вопрос обсуждения — как вы это делаете. Какие виды исследований требуются? Какие доказательства вам нужны? Если вы изучаете одну конкретную группу биомаркеров, какие доказательства вам нужны для другой группы, которая может не входить в эту категорию (то есть «отрицательная» для биомаркера)? Так что некоторые вопросы еще не решены. Но нет, я не думаю, что есть возражения против принципа персонализированной медицины.
Вы ранее говорили об индустрии — как индустрия в целом реагирует на концепцию персонализированной медицины?
Если вы поговорите с представителями промышленности, то, похоже, есть большой энтузиазм по поводу того, куда может идти наука. Я думаю, что это особенно верно из-за нескольких руководств, которые мы опубликовали в этой области или пообещали разработать в рамках повторных разрешений PDUFA.
Я думаю, что это особенно верно из-за нескольких руководств, которые мы опубликовали в этой области или пообещали разработать в рамках повторных разрешений PDUFA.
Некоторые компании имеют персонализированные медицинские группы, хотя их можно назвать группами «фармакогеномики» или группами «стратифицированной медицины», которые, очевидно, с большим энтузиазмом относятся к науке.Тем не менее, недавнее исследование изучило портфели лекарств примерно 20 крупных компаний и показало, что очень небольшое меньшинство включает то, что можно назвать стратифицированной или персонализированной медициной. Когда вы спрашиваете об этом людей в промышленности, некоторые думают, что это потому, что нет четких нормативов или руководящих принципов.
Мы работали над созданием этой структуры. Руководства были разработаны или разрабатываются, чтобы помочь людям включить принципы персонализированной медицины на ранних этапах разработки лекарств, а затем использовать эту информацию для принятия решений о выборе пациентов или дизайне клинических испытаний на более поздних этапах разработки лекарств. Я думаю, что это руководство, наряду с нашим обязательством по разработке скоординированных процессов обзора между CDER, CDRH и другими центрами, создаст больше уверенности в том, что существует нормативная база для обращения с персонализированными лекарствами.
Я думаю, что это руководство, наряду с нашим обязательством по разработке скоординированных процессов обзора между CDER, CDRH и другими центрами, создаст больше уверенности в том, что существует нормативная база для обращения с персонализированными лекарствами.
О каком таймфрейме идет речь?
Мы опубликовали проект руководства по фармакогенетике на ранних этапах разработки в феврале прошлого года и получили комментарии от общественности. Сейчас мы находимся в процессе изменения руководства на основе этих комментариев.Еще одно актуальное руководство касается стратегий обогащения на более поздних этапах разработки лекарств и включает компонент геномики как один из видов обогащения. Это руководство было обещано в соответствии с последним Законом о плате за рецептурные лекарства (PDUFA IV), и в настоящее время над ним работают. Мы также выпустили проект правил и рекомендаций по сопутствующей диагностике, работа над которым сейчас завершается. Еще одно руководство, касающееся совместной разработки, находится на начальной стадии.
Мы также работаем над различными политиками и процедурами для координации проверки лекарств и диагностических средств одновременно, как только заявки поступают в рамках заявки на исследуемый новый лекарственный препарат, заявки на новый лекарственный препарат или заявки на получение лицензии на биологический препарат.Итак, что касается сроков, руководство и другие документы варьируются от готовящихся к выпуску в окончательной форме до ранних стадий разработки.
Как повторная авторизация PDUFA повлияла на сферу персонализированной медицины, если вообще повлияла?
Одно из предложений по усовершенствованию, включенных в недавнюю повторную авторизацию PDUFA V, связано с персонализированной медициной. При разработке предложения мы сделали убедительное научное и экономическое обоснование для дальнейшего расширения инфраструктуры, поддерживающей процесс обзора.Мы привели несколько хороших примеров того, как обзор способствовал продвижению персонализированной медицины, и общественные заинтересованные стороны и отрасль согласились с этим.
В результате это предложение по усовершенствованию позволяет увеличить штат сотрудников CDER для анализа и разработки рекомендаций в области персонализированной медицины. Предложение также включает положение о проведении открытого семинара для изучения того, как FDA, промышленность, внешние ученые и консорциумы могут более гибко взаимодействовать для развития науки о биомаркерах, фармакогеномики и других суб-дисциплин в персонализированной медицине.
Таким образом, новое предложение даст нам больше сотрудников, а также больше возможностей для диалога. Эти две вещи вместе с нашими достижениями в области разработки и анализа политики означают, что мы будем в очень хорошей форме для дальнейшего прогресса в течение следующих пяти лет.
И, наконец, как персонализированная медицина повлияет на пациентов?
Что ж, это ключевой вопрос. Чтобы понять перспективы фармакогеномики, давайте посмотрим, как мы в настоящее время лечим пациентов. Если вы обратитесь к врачу, например, по поводу повышенного кровяного давления, он или она назначит вам любое из ряда лекарств от кровяного давления, основываясь на очень небольшой информации о том, что подействует на вас. Фактически, может не быть никакого объяснения того, почему вы принимаете это конкретное лекарство, кроме того, что ваша страховка покрывает его или у врача есть образцы. Если лекарство не подействует через четыре-шесть недель, вас могут переключить на другое лекарство или добавить другое лекарство вместо первого.
Фактически, может не быть никакого объяснения того, почему вы принимаете это конкретное лекарство, кроме того, что ваша страховка покрывает его или у врача есть образцы. Если лекарство не подействует через четыре-шесть недель, вас могут переключить на другое лекарство или добавить другое лекарство вместо первого.
Мы узнали, что такой подход, основанный на пробах и ошибках, приводит к неудовлетворенности пациентов, плохим клиническим результатам и большим расходам, особенно при хронических заболеваниях. Но во многих ситуациях этот эмпирический подход — лучший подход, который у нас есть.Персонализированная медицина направлена на рационализацию принятия клинических решений, используя биологическую информацию, доступную с помощью генетического теста или биомаркера, а затем говоря: «на основе этого профиля, я думаю, вы с большей вероятностью ответите на лекарство A или лекарство B или с меньшей вероятностью иметь побочную реакцию с препаратом С. » Идея состоит в том, чтобы направить пациентов на правильные лекарства и назначить их раньше.
Если мы сможем на более раннем этапе включить персонализированные концепции медицины в нормативный обзор и разработку лекарств, мы сможем разрабатывать лекарства с более высокой вероятностью успеха в определенных группах населения.Пациенты, которые с наибольшей вероятностью покажут вам, что лекарство работает, если лекарство действительно работает, могут быть идентифицированы заранее как часть разработки лекарства. В идеале это привело бы к более эффективным лекарствам и лучшему пониманию групп населения, в которых эти лекарства работают. Это также дало бы нам больше знаний о профилях безопасности, лучшее представление о том, кто может столкнуться с серьезными или опасными для жизни нежелательными явлениями, и дополнительную информацию о дозировании. Если вы сложите все это вместе, у вас будет гораздо более тонкий подход к лечению пациентов с точки зрения выбора лекарств, дозирования лекарств и наблюдения за пациентом.
###
Иссам Зинех — директор Управления клинической фармакологии (OCP) и содиректор программы квалификации биомаркеров Управления трансляционных наук, CDER / FDA. С 2008 по 2012 год д-р Зинех была заместителем директора по геномике в OCP. Он — опытный клинический фармацевт, ранее работавший на факультете фармацевтических и медицинских колледжей Университета Флориды (UF) и заместитель директора Центра фармакогеномики UF. Доктор Зинех получил степень фармацевта в Северо-Восточном университете и закончил резидентуру в Медицинском центре Университета Дьюка.Он прошел стажировку в области фармакогеномики сердечно-сосудистой системы в UF, где также получил степень магистра здравоохранения в области политики и управления в области здравоохранения. Он является признанным экспертом в области клинической фармакологии, фармакотерапии и фармакогеномики. Д-р Зинех является председателем Консультативной группы по совместной фармакогеномике Coriell Personalized Medicine и входит в руководящий комитет EGAPP Центров по контролю и профилактике заболеваний. В качестве директора OCP д-р Зинех входит в состав старшего руководства CDER и возглавляет штат из почти 150 ученых-регуляторов в усилиях FDA по совершенствованию разработки лекарственных препаратов и продвижению регуляторных инноваций с помощью прикладной клинической фармакологии.
С 2008 по 2012 год д-р Зинех была заместителем директора по геномике в OCP. Он — опытный клинический фармацевт, ранее работавший на факультете фармацевтических и медицинских колледжей Университета Флориды (UF) и заместитель директора Центра фармакогеномики UF. Доктор Зинех получил степень фармацевта в Северо-Восточном университете и закончил резидентуру в Медицинском центре Университета Дьюка.Он прошел стажировку в области фармакогеномики сердечно-сосудистой системы в UF, где также получил степень магистра здравоохранения в области политики и управления в области здравоохранения. Он является признанным экспертом в области клинической фармакологии, фармакотерапии и фармакогеномики. Д-р Зинех является председателем Консультативной группы по совместной фармакогеномике Coriell Personalized Medicine и входит в руководящий комитет EGAPP Центров по контролю и профилактике заболеваний. В качестве директора OCP д-р Зинех входит в состав старшего руководства CDER и возглавляет штат из почти 150 ученых-регуляторов в усилиях FDA по совершенствованию разработки лекарственных препаратов и продвижению регуляторных инноваций с помощью прикладной клинической фармакологии.
Связанная информация
Что такое персонализированная противораковая медицина?
Возможно, вы слышали термин «персонализированная медицина». Это означает, что ваша медицинская помощь основана на ваших генах и вашем конкретном заболевании. Гены — это информация, которая сообщает клеткам вашего тела, как расти и развиваться. Многие виды рака влияют на определенные гены или затрагивают их. Узнайте больше о раке и своих генах. Этот подход также можно назвать «точной медициной».
Персонализированная медицина рака основана на исследованиях генов человека и генов различных видов рака.Эти исследования помогли исследователям разработать более эффективные методы лечения. Они также использовали генетическую информацию для разработки тестов на рак и способов его предотвращения.
Персонализированное лекарство от рака может иметь меньше побочных эффектов, чем другие виды лечения. Это потому, что он разработан, чтобы быть более конкретным. Персонализированное лечение может меньше повлиять на здоровые клетки и больше на клетки, вызывающие рак.
Ваш врач может работать с вами над составлением индивидуального плана скрининга рака или лечения рака.Это может включать:
Изучение ваших шансов на развитие рака и выбор скрининговых тестов для снижения риска.
Сопоставление лечения с вашими генами и генами вашего рака. Это может быть более эффективным и вызывать меньше побочных эффектов.
Прогнозирование вероятности рецидива рака. Врачи называют это «риском рецидива».
Чем отличается персонализированная медицина
До появления персонализированной медицины люди с одним и тем же типом рака обычно получали одинаковое лечение.Со временем врачи заметили, что у одних лечение работает лучше, чем у других.
Затем исследователи начали обнаруживать генетические различия у людей и их рака. Эти различия во многом объясняют, почему рак по-разному реагировал на одно и то же лечение.
Сегодня у вас все еще может быть обычное лечение вашего типа и стадии рака. Но ваш врач может персонализировать его на основе информации о ваших генах и генах рака. Это персонализированное лекарство от рака.Персонализированная медицина также может быть частью клинических испытаний. Клиническое испытание — это научное исследование с участием добровольцев.
Но ваш врач может персонализировать его на основе информации о ваших генах и генах рака. Это персонализированное лекарство от рака.Персонализированная медицина также может быть частью клинических испытаний. Клиническое испытание — это научное исследование с участием добровольцев.
Примеры персонализированной медицины от рака
Примеры персонализированной медицины рака включают:
Таргетная терапия
Целевое лечение нацелено на определенные гены и белки, которые позволяют определенному раку расти и выживать. С каждым годом исследователи находят новые цели для увеличения количества раковых заболеваний. Затем они создают и тестируют новые лекарства для этих целей.
Раковые опухоли с целевыми вариантами лечения для некоторых пациентов включают:
Вы можете узнать больше о целевых методах лечения определенных типов рака в разделе «Типы рака» Cancer.Net.
Вы можете пройти таргетную терапию, если ваш рак имеет цель, для которой было разработано лечение. Вашему врачу необходимо провести анализ крови, костного мозга или опухолевой ткани, чтобы узнать это. Врач даст рекомендации по лечению на основе этих результатов, а также других факторов.
Вашему врачу необходимо провести анализ крови, костного мозга или опухолевой ткани, чтобы узнать это. Врач даст рекомендации по лечению на основе этих результатов, а также других факторов.
Фармакогеномика
Исследователи могут изучить, как ваши гены влияют на вашу реакцию на лекарства. Это называется фармакогеномикой. То, как ваши гены влияют на лекарства в вашем организме, имеет значение. Он определяет, насколько хорошо лекарство действует на вас и насколько оно безопасно.
Например, вы можете обработать определенный препарат быстрее, чем большинство людей. Так он проходит через вашу систему быстрее. Это означает, что вам может потребоваться более высокая доза, чтобы лекарство подействовало так же хорошо, как и для большинства людей.
Или вы можете обрабатывать лекарство медленнее, чем большинство людей. Таким образом, он остается в вашем кровотоке дольше, чем обычно. У вас может быть больше побочных эффектов или вам потребуется меньшая доза.
Будущее персонализированной медицины рака
Персонализированная медицина рака может сделать лечение рака более эффективным с меньшим количеством побочных эффектов. Но есть еще некоторые проблемы. К ним относятся:
Но есть еще некоторые проблемы. К ним относятся:
Индивидуальное лечение доступно не для всех типов и подтипов рака.
Некоторые индивидуальные методы лечения доступны только в клинических испытаниях.
Генетическое тестирование может быть дорогим. Страховые планы не всегда оплачиваются. Кроме того, тестирование ваших генов и генов опухоли требует времени. Это может означать, что вам придется дольше ждать, чтобы получить индивидуальное лечение.
Некоторые индивидуальные методы лечения, например целенаправленные, могут быть дорогими.
Исследователи все еще разрабатывают индивидуализированные лекарства от рака.Они хотят узнать больше о:
Изменения генов, происходящие в раковых клетках.
Как работают индивидуальные методы лечения рака.
Почему перестают работать некоторые целевые методы лечения. Таргетная терапия — это разновидность персонализированной медицины рака.

Обсудите со своим лечащим врачом любые вопросы о персонализированной медицине, в том числе выясните, будет ли это включать в ваш план лечения.
Вопросы, которые следует задать бригаде здравоохранения
Чтобы узнать больше, задайте своим медицинским работникам следующие вопросы:
Какие у меня варианты лечения?
Какие клинические испытания открыты для меня?
Доступны ли генетические тесты для выбора лечения?
Считается ли это лечение персонализированной медициной? Если да, то как?
Каковы возможные преимущества этого лечения?
Каковы возможные побочные эффекты этого лечения?
Каковы мои шансы на выздоровление?
Связанные ресурсы
Близкое и личное знакомство с патологией вашего рака
Опухолево-агностическое лечение рака: опыт экспертов
Открытие и разработка лекарств
Вопросы о стоимости
Дополнительная информация
Национальный институт рака: точная медицина в лечении рака
Рак Уход : понимание роли персонализированной медицины
Точная или индивидуальная медицина | Точная медицина рака
Что такое точная медицина?
Точная медицина — это способ, с помощью которого поставщики медицинских услуг могут предлагать и планировать конкретную помощь своим пациентам на основе генов человека (или генов в его раковых клетках). Иногда его называют персонализированная медицина или персонализированная помощь . Точная медицина изучает, как конкретное изменение гена (генная мутация) может повлиять на риск человека заболеть определенным раком или, если у него уже есть рак, как его гены (или гены в его раковых клетках) могут повлиять на лечение.
Иногда его называют персонализированная медицина или персонализированная помощь . Точная медицина изучает, как конкретное изменение гена (генная мутация) может повлиять на риск человека заболеть определенным раком или, если у него уже есть рак, как его гены (или гены в его раковых клетках) могут повлиять на лечение.
Подход использует информацию генетических тестов, чтобы помочь врачам составить план лечения, который обычно включает очень конкретные рекомендации. В некоторых случаях точная медицина может помочь поставить более точный диагноз и улучшить лечение.В других случаях это может помочь людям принять решение о здоровых привычках, более ранних скрининговых тестах и других мерах по профилактике, если они подвержены риску заболевания определенным раком.
Ваши поставщики медицинских услуг могут не использовать точные слова «точная медицина» или «персонализированная медицина». Вместо этого они могут поговорить с вами о генетическом, геномном, ДНК или молекулярном тестировании. Или они могут поговорить о поиске биомаркеров или получении генетического профиля. Это способы, которыми врачи и другие поставщики медицинских услуг могут использовать подход точной медицины при планировании вашего лечения.
Или они могут поговорить о поиске биомаркеров или получении генетического профиля. Это способы, которыми врачи и другие поставщики медицинских услуг могут использовать подход точной медицины при планировании вашего лечения.
Что такое генные мутации?
Точная медицина основана на знании последствий определенных мутаций (изменений) генов. Размышляя о точной медицине, может быть полезно понять, что такое генные мутации и как они могут повлиять на риск рака или лечения рака у человека.
Каждая клетка человеческого тела имеет ДНК, которая содержит наших генов . Гены — это инструкции, которые ваши клетки используют для производства белков, необходимых для нормальной работы вашего тела.
Когда клетки делятся, чтобы образовать новые клетки, гены внутри этих клеток копируются. Смена гена происходит, когда в процессе копирования происходит ошибка. Иногда эти изменения исходят от родителя ( унаследованных генных изменений). Но они могут произойти и в более позднем возрасте ( приобрели генных изменений). Некоторые изменения генов могут быть вредными, в то время как другие могут не вызывать никаких проблем.
Но они могут произойти и в более позднем возрасте ( приобрели генных изменений). Некоторые изменения генов могут быть вредными, в то время как другие могут не вызывать никаких проблем.
Генные мутации и рак
Все виды рака вызваны каким-либо генетическим изменением или мутацией.Раковые клетки — это мутировавшие версии нормальных клеток, то есть что-то изменилось в нормальной клетке, заставив ее превратиться в раковую. Эксперты сходятся во мнении, что для возникновения рака требуется не одна мутация гена в клетке.
Хотя мы еще не знаем всех генов и мутаций, которые могут быть вовлечены в развитие рака, есть некоторые из них, о которых мы знаем и можем проверить. В зависимости от типа мутации аномальное изменение гена может повысить вероятность развития у человека определенного рака.Или, если у них уже есть рак, аномальный ген может означать, что рак может плохо реагировать на определенный тип лечения или лекарства. У некоторых людей с раком конкретная мутация гена может означать, что их прогноз (результат) лучше или хуже, чем у людей с таким же раком, у которых этот ген не изменился.
Например, когда у человека диагностируют рак, он часто получает такое же лечение, как и другие люди с этим типом рака. Иногда для лечения рака с определенным патологическим геном используется конкретное лекарство.Но изменения генов могут быть разными у разных людей, даже если у них один и тот же тип рака. Из-за этого у каждого из этих людей может быть разная реакция на одно и то же лекарство. При определенных типах рака врачи могут проверить изменения генов, которые могут сказать им, может ли человек лучше реагировать на один препарат, чем на другой.
Вы можете узнать больше в разделе «Генетика и рак».
Точная медицина при раке
Прецизионная медицина используется для лечения некоторых видов рака, чтобы узнать, какие тесты и лечение лучше всего.Врачи могут использовать точную медицину, чтобы помочь им:
- Определите, кто может быть подвержен высокому риску рака
- Профилактика некоторых видов рака
- Раннее обнаружение определенных видов рака
- Правильно диагностировать конкретный тип рака
- Выберите оптимальные варианты лечения
- Оцените эффективность лечения
Риск рака и профилактика
Иногда точная медицина используется для людей с определенными видами рака или людей с повышенным риском развития определенных видов рака. Например, человек может понять, что рак передается в его семье, или его врач может заметить образец рака в его семье. В этих случаях пациент может встретиться с сертифицированным генетическим консультантом и рассмотреть возможность проведения генетического тестирования. Тестирование может показать, есть ли у них изменение гена или мутация, которая подвергает их более высокому риску развития определенных типов рака. Если это так, врач может порекомендовать скрининг и другие тесты (часто в более молодом возрасте, чем обычно), чтобы помочь обнаружить рак на ранней стадии, а также прописать лекарства или предложить здоровые привычки, которые могут помочь снизить риск рака.
Например, человек может понять, что рак передается в его семье, или его врач может заметить образец рака в его семье. В этих случаях пациент может встретиться с сертифицированным генетическим консультантом и рассмотреть возможность проведения генетического тестирования. Тестирование может показать, есть ли у них изменение гена или мутация, которая подвергает их более высокому риску развития определенных типов рака. Если это так, врач может порекомендовать скрининг и другие тесты (часто в более молодом возрасте, чем обычно), чтобы помочь обнаружить рак на ранней стадии, а также прописать лекарства или предложить здоровые привычки, которые могут помочь снизить риск рака.
Диагноз рака
Для людей с диагнозом рака их опухоль может быть проверена на наличие определенных типов изменений генов или белков, вызванных этими изменениями генов. Это тестирование может предоставить информацию о том, как их рак растет и распространяется. Эти тесты могут называться тестов на биомаркеры, хромосомных тестов , генных тестов, или биохимических тестов . Это может быть сделано с использованием образца крови или слюны, биопсии ткани или биологических жидкостей.Если тест проводится с использованием образца биопсии (из опухоли), он проводится в специальной лаборатории и может называться другими названиями, например, ДНК-мутационный анализ , геномное тестирование , протеомика , тестирование биомаркеров , профилирование опухоли, цитогенетика , секвенирование нового поколения или молекулярное тестирование .
Это может быть сделано с использованием образца крови или слюны, биопсии ткани или биологических жидкостей.Если тест проводится с использованием образца биопсии (из опухоли), он проводится в специальной лаборатории и может называться другими названиями, например, ДНК-мутационный анализ , геномное тестирование , протеомика , тестирование биомаркеров , профилирование опухоли, цитогенетика , секвенирование нового поколения или молекулярное тестирование .
Лечение рака
При некоторых формах рака тестирование гена опухоли может повлиять на выбор лечения.Это связано с тем, что определенные изменения генов могут повлиять на реакцию опухоли на определенное лечение. И некоторые опухоли имеют генетические изменения, отличные от других опухолей того же типа. Например, не каждый меланомный рак кожи будет иметь одни и те же генные мутации. Это означает, что эти опухоли могут не реагировать на лечение одинаково. Цель состоит в том, чтобы дать лечение, которое нацелено на мутацию гена, не вызывая слишком много побочных эффектов, и избежать лечения, которое может не работать. Вы можете узнать больше о 2 типах лечения, которые часто используются в точной медицине: таргетная терапия и иммунотерапия.
Цель состоит в том, чтобы дать лечение, которое нацелено на мутацию гена, не вызывая слишком много побочных эффектов, и избежать лечения, которое может не работать. Вы можете узнать больше о 2 типах лечения, которые часто используются в точной медицине: таргетная терапия и иммунотерапия.
Вы также можете узнать больше о том, как гены могут помочь в диагностике и лечении рака.
Типы рака, при которых применяется точная медицина
Важно понимать, что точная медицина применяется не для всех видов рака. Однако есть надежда, что однажды лечение будет адаптировано к конкретным генетическим изменениям, связанным с раком каждого человека. В этой области проводится много исследований.
Некоторые из наиболее распространенных видов рака, при которых точная медицина используется для принятия решений о лечении, включают:
- Колоректальный рак
- Рак груди
- Рак легких
- Некоторые виды лейкозов
- Некоторые виды лимфомы
- Меланома
- Рак пищевода
- Рак желудка
- Рак яичников
- Рак щитовидной железы
Если доступно лечение для нацеливания на мутацию гена, которая часто встречается при вашем типе рака, вы (или ваша опухоль), скорее всего, будете проверены на это. Возможно, вам придется задать своему врачу несколько вопросов, чтобы узнать, проводилось ли тестирование. Людей с перечисленными выше видами рака обычно проверяют на наличие определенных изменений генов при постановке диагноза или вскоре после этого. Некоторые виды рака также проверяются, если они ухудшаются или возвращаются.
Возможно, вам придется задать своему врачу несколько вопросов, чтобы узнать, проводилось ли тестирование. Людей с перечисленными выше видами рака обычно проверяют на наличие определенных изменений генов при постановке диагноза или вскоре после этого. Некоторые виды рака также проверяются, если они ухудшаются или возвращаются.
Недостатки и ограничения точной медицины при раке
Доступ к последним исследованиям точной медицины может быть ограничен. Еще многое предстоит узнать о том, как точную медицину можно использовать при раке.Исследователи пытаются восполнить эти пробелы как в лабораториях, так и в клинических испытаниях.
Многие клинические испытания проводятся с пациентами с определенными типами и стадиями рака. Но чтобы участвовать в клинических испытаниях точной медицины, у человека должно быть определенное генетическое изменение, на которое может воздействовать тестируемое лекарство. А клинические испытания точной медицины часто доступны только в крупных онкологических центрах. Это означает, что иногда шансы участвовать в клинических испытаниях могут быть ограничены.
Это означает, что иногда шансы участвовать в клинических испытаниях могут быть ограничены.
Даже когда прецизионная медицина доступна вне клинических испытаний, она не всегда может использоваться так хорошо, как могла бы. Например:
- Семейный анамнез больного раком может быть недостаточно известен или оценен. Или генетическое тестирование могло не проводиться, его результаты могут быть неадекватными, или его результаты не используются для принятия решений о здоровье.
- Даже если у человека диагностирован тип рака, при котором доступны генные тесты, опухоль может не быть проверена, чтобы выяснить, есть ли генная мутация, которая может изменить выбор лечения.
- Стоимость тестирования генов, а также тестов и лекарств, которые могут быть рекомендованы в результате тестирования генов, могут быть проблемой.
Важно задавать вопросы и знать все доступные вам варианты.
Стоимость точной медицины при раке
Эксперты считают, что точная медицина может в некоторой степени снизить расходы на здравоохранение. Это потому, что точная медицина может помочь врачам выбрать правильные тесты, которые затем могут помочь им выбрать лечение, которое будет работать лучше всего и, надеюсь, будет иметь наименьшее количество побочных эффектов.Это означает, что пациент может избегать лечения, которое вряд ли будет эффективным, а также будет иметь ненужные побочные эффекты.
Это потому, что точная медицина может помочь врачам выбрать правильные тесты, которые затем могут помочь им выбрать лечение, которое будет работать лучше всего и, надеюсь, будет иметь наименьшее количество побочных эффектов.Это означает, что пациент может избегать лечения, которое вряд ли будет эффективным, а также будет иметь ненужные побочные эффекты.
Но точная медицина также может увеличить некоторые затраты. Например:
- Тесты на генные мутации могут быть дорогими, а страховка может не покрыть все расходы на генетическое консультирование или тестирование.
- Для людей, которые подвержены высокому риску рака из-за мутации гена, могут возникнуть дополнительные расходы из-за рекомендованных обследований и другой профилактической помощи.(С другой стороны, они делают то, что необходимо, чтобы помочь предотвратить диагноз рака или выявить его на ранней стадии, когда его часто легче лечить, что может предотвратить более высокие затраты в будущем.)
- Для людей, которым необходима специфическая таргетная терапия или иммунотерапевтическое лечение из-за генетической структуры опухоли, лекарство может быть очень дорогим.

Вопросы о точной медицине, которые следует задать врачу
Если вас беспокоит риск рака
Если у вас нет рака, но вы обеспокоены его риском рака из-за семейного анамнеза или по другой причине, вот несколько вопросов, которые вы можете задать своему врачу:
- Считаете ли вы, что моя семейная история подвергает меня высокому риску рака?
- Следует ли мне пройти генетическое консультирование и тестирование?
- Как мне найти консультанта-генетика?
- Что будет, если я решу пройти генетическое тестирование? Что будет, если я решу не делать этого?
- Сколько стоит генетическое консультирование и тестирование? Покроет ли это моя страховка?
- Что вы можете узнать о моем риске рака из генетического тестирования?
- Как результаты повлияют на мое лечение?
- Приведут ли результаты к дополнительным медицинским тестам?
- Как результаты повлияют на мою семью? Нужно ли членам моей семьи проходить генетическое тестирование?
Дополнительную информацию можно найти в разделе «Общие сведения о генетическом тестировании на рак».
Если у вас рак
Если у вас рак, особенно один из видов рака, перечисленных выше в разделе «Типы рака, при котором используется прецизионная медицина», вот несколько вопросов, которые вы можете задать своему врачу:
- Есть ли у меня тип рака, для которого нужно провести биомаркеры или молекулярное тестирование?
- Помогут ли анализы моей опухоли узнать больше о моем раке?
- Означают ли результаты этого генного тестирования, что мне нужно больше тестов?
- Сколько будут стоить биомаркеры или молекулярные тесты? Покроет ли их моя страховка?
- Помогут ли эти тесты выбрать наиболее подходящее для меня лечение?
- Сколько будет стоить мое лечение? Покроет ли это моя страховка?
Вы можете узнать больше о том, какие вопросы задавать, в разделе «Понимание ваших возможностей и принятие решений о лечении».
Точная медицина и фармакогеномика — клиника Мэйо
Точная медицина и фармакогеномика
Персонализированная медицина обещает, что однажды лечение будет адаптировано к вашей генетической структуре.
Современные лекарства спасают миллионы жизней в год. Однако любое лекарство может не подействовать на вас, даже если оно подействует на других людей. Или это может вызвать серьезные побочные эффекты у вас, но не у кого-то другого.
Ваш возраст, образ жизни и здоровье влияют на вашу реакцию на лекарства. Но ваши гены тоже. Фармакогеномика — это исследование того, как уникальный генетический состав (геном) человека влияет на его или ее реакцию на лекарства.
Что такое точная медицина?
Прецизионная медицина направлена на то, чтобы персонализировать здравоохранение, с решениями и лечением, адаптированными для каждого человека всеми возможными способами. Фармакогеномика — это часть точной медицины.
Хотя геномное тестирование все еще является относительно новым явлением в лечении лекарств, эта область быстро расширяется.В настоящее время более 200 лекарств имеют информацию на этикетках относительно фармакогеномных биомаркеров — некоторую измеримую или идентифицируемую генетическую информацию, которая может использоваться для индивидуализации использования лекарства.
Чем полезна геномная информация?
Каждый ген обеспечивает план производства определенного белка в организме. Определенный белок может играть важную роль в лекарственном лечении по одной из нескольких причин, в том числе по следующей:
- Белок играет роль в расщеплении препарата.
- Помогает при абсорбции или транспортировке препарата.
- Белок является мишенью препарата.
- Он играет определенную роль в серии молекулярных событий, запускаемых препаратом.
Когда исследователи сравнивают геномы людей, принимающих одно и то же лекарство, они могут обнаружить, что группа людей с определенной генетической вариацией также имеет общий ответ на лечение, например:
- Повышенный риск побочных эффектов
- Необходимость более высокой дозы для достижения терапевтического эффекта
- Нет пользы от лечения
- Больший или более вероятный эффект от лечения
- Оптимальная продолжительность лечения
Этот вид лечебной информации в настоящее время используется для улучшения выбора и дозировки лекарств для лечения широкого спектра состояний, включая сердечно-сосудистые заболевания, заболевания легких, ВИЧ-инфекцию, рак, артрит, высокий уровень холестерина и депрессию.
В лечении рака существует два генома, которые могут влиять на решение о назначении лекарств: геном человека, больного раком (геном зародышевой линии) и геном раковой (злокачественной) опухоли (соматический геном).
Существует множество причин рака, но большинство видов рака связано с повреждением ДНК, которое позволяет клеткам беспрепятственно расти. «Неправильный» генетический материал неконтролируемого роста — злокачественная опухоль — на самом деле представляет собой отдельный геном, который может дать ключи к лечению.
Как фармакогеномика работает на практике?
Одним из примеров является тестирование тиопуринметилтрансферазы (TPMT) для людей, которые являются кандидатами на терапию тиопуриновыми препаратами. Тиопуриновые препараты используются для лечения некоторых аутоиммунных заболеваний, включая болезнь Крона и ревматоидный артрит, а также некоторых типов рака, например лейкемии у детей.
Фермент TPMT помогает расщеплять тиопуриновые препараты. Люди с дефицитом TPMT не распадаются и не выводят эти препараты достаточно быстро.В результате концентрация препарата в организме слишком высока и увеличивает риск побочных эффектов, таких как повреждение костного мозга (гемопоэтическая токсичность).
Люди с дефицитом TPMT не распадаются и не выводят эти препараты достаточно быстро.В результате концентрация препарата в организме слишком высока и увеличивает риск побочных эффектов, таких как повреждение костного мозга (гемопоэтическая токсичность).
Генетическое тестирование может выявить людей с дефицитом TPMT , чтобы их врачи могли предпринять шаги для снижения риска серьезных побочных эффектов — назначив более низкие, чем обычно, дозы тиопуриновых препаратов или вместо этого используя другие препараты.
Будущее фармакогеномики
Хотя фармакогеномика имеет большие перспективы и в последние годы добилась важных успехов, она все еще находится на начальной стадии.Клинические испытания необходимы не только для выявления связей между генами и результатами лечения, но и для подтверждения первоначальных результатов, уточнения значения этих ассоциаций и их воплощения в руководствах по назначению.
Тем не менее, прогресс в этой области указывает на то, что наступит время, когда фармакогеномика станет частью повседневной медицинской помощи — по крайней мере, для некоторых лекарств.
3 сентября 2020 г. Показать ссылки- Точная медицина. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США.https://www.fda.gov/medicaldevices/productsandmedicalprocedures/invitrodiagnostics/precisionmedicine-medicaldevices/default.htm. Доступ 31 июля 2018 г.
- Godman B, et al. Персонализация здравоохранения: осуществимость и будущие последствия. BMC Medicine. 2013; 11: 179.
- Tremblay J, et al. Роль геномики на пути к персонализированной медицине. Обмен веществ. 2013; 62 (доп.): S2.
- Wang L, et al. Геномика и лекарственный ответ. Медицинский журнал Новой Англии. 2011; 364: 1144.
- Weinshilboum RM, et al. Фармакогеномика: прецизионная медицина и лекарственный ответ. Труды клиники Мэйо.
 2017; 92: 1711.
2017; 92: 1711. - Часто задаваемые вопросы о фармакогеномике. Национальный институт исследования генома человека. http://www.genome.gov/27530645. Доступ 31 июля 2018 г.
- Фармакогеномика. Национальный институт общих медицинских наук. https://www.nigms.nih.gov/education/Pages/factsheet-pharmacogenomics.aspx. Доступ 31 июля 2018 г.
- Центр обучения пациентов «Барбара Вудворд Липс».Что нужно знать о фармакогеномном тестировании. Рочестер, Миннесота: Фонд Мейо медицинского образования и исследований; 2018.
- Точная медицина: что это значит для вашего здоровья? Центры по контролю и профилактике заболеваний. https://www.cdc.gov/features/precision-medicine/. Доступ 31 июля 2018 г.
- Дефицит тиопурин-S-метилтрансферазы. Домашний справочник по генетике. https://ghr.nlm.nih.gov/condition/thiopurine-s-methyltransferase-deficiency. Проверено 14 сентября 2018 г.
- AskMayoExpert. Тиопурины и TPMT и NUDT15 (фармакогеномика).
 Рочестер, Миннесота: Фонд медицинского образования и исследований Мэйо, 2018.
Рочестер, Миннесота: Фонд медицинского образования и исследований Мэйо, 2018.
Продукты и услуги
- The Mayo Clinic Diet Online
- Книга: The Mayo Clinic Diet
.
Реализация перспектив персонализированной медицины
За последнее десятилетие научные достижения позволили диагностировать и лечить быстро растущее число заболеваний, особенно различных типов рака, намного раньше и с большей точностью, чем когда-либо прежде.Эти разработки значительно расширили возможности врачей подбирать терапию, повышая эффективность медикаментозного лечения и сводя к минимуму их побочные эффекты. Это хорошие новости. Плохая новость заключается в том, что прогресс в реализации перспектив персонализированной медицины в Соединенных Штатах и во всем мире был медленным и неравномерным. Хотя наука всегда опережает практику в области медицины, сегодня разрыв в области персонализированной медицины непростительно велик.
Сегодня большинство U.Врачи С. продолжают практиковать традиционную медицину проб и ошибок. У пациента появляются симптомы, и врач ставит «наиболее вероятный» диагноз, соответствующий этим симптомам, затем назначает лекарство и, возможно, другое лечение, например хирургическое вмешательство. Дозировка лекарства обычно зависит от веса пациента. Если препарат не действует или имеет серьезные побочные эффекты, врач может изменить дозировку или попробовать другой препарат, если он доступен. В качестве альтернативы врач может отказаться от первоначального диагноза в пользу другого и выписать новый рецепт.Этот цикл повторяется до тех пор, пока не будет обнаружен правильный или более точный диагноз и план лечения.
Напротив, персонализированная медицина использует гораздо более совершенные диагностические тесты для точного определения болезни в самом начале. Затем, чтобы выбрать лучшее лечение и определить правильную дозировку, врачи, использующие индивидуальный подход к медицине, принимают во внимание уникальную физиологию пациента; физиология опухоли, вируса или бактерий, если применимо; и способность пациента усваивать определенные лекарства.
Безусловно, медицине проб и ошибок нет альтернативы для множества болезней из-за глубоких пробелов в знаниях об их причинах, о биологических маркерах их наличия или стадии, а также о факторах, которые влияют на эффективность возможных заболеваний. Средства. Однако вызывает тревогу то, в какой степени метод проб и ошибок сохраняется, даже когда такие знания действительно существуют.
Четыре препятствия препятствуют переходу от медицины проб и ошибок к персонализированной медицине в США.S. и, в той или иной степени, остальной мир. Во-первых, это исторически успешная модель блокбастера фармацевтической промышленности , которая фокусируется на разработке и маркетинге лекарств для максимально широкой группы пациентов и препятствует разработке методов лечения, направленных на меньшие группы пациентов, и диагностических тестов, которые могут их идентифицировать. Далее следует нормативная среда , из-за которой слишком много ресурсов выделяется на третью фазу клинических испытаний («заключительные экзамены» на эффективность и безопасность нового лекарства) и слишком мало — на мониторинг и оценку после U. S. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов одобрило лекарство. В-третьих, извращенная экономика дисфункциональной платежной системы , которая вознаграждает врачей за активность (выполнение процедур и назначение лекарств), а не за раннюю диагностику и профилактику. Последний барьер — это поведение врача , которое глубоко укоренилось в медицине проб и ошибок. В этой статье мы исследуем, как эти препятствия мешают прогрессу, и предлагаем способы их преодоления. Мы ориентируемся на Соединенные Штаты, но многие из рекомендуемых нами решений также могут применяться в других странах.
S. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов одобрило лекарство. В-третьих, извращенная экономика дисфункциональной платежной системы , которая вознаграждает врачей за активность (выполнение процедур и назначение лекарств), а не за раннюю диагностику и профилактику. Последний барьер — это поведение врача , которое глубоко укоренилось в медицине проб и ошибок. В этой статье мы исследуем, как эти препятствия мешают прогрессу, и предлагаем способы их преодоления. Мы ориентируемся на Соединенные Штаты, но многие из рекомендуемых нами решений также могут применяться в других странах.
Ставки
Ускорение внедрения персонализированной медицины чрезвычайно важно с точки зрения спасения как жизней, так и денег.
Спасение жизней.
Люди с острыми заболеваниями не могут позволить себе лишнего времени, которое часто требуется для диагностики и лечения методом проб и ошибок (см. Выставку «Быстро убивающие рак»). Рак легких — хороший тому пример. Только 43% всех пациентов с раком легких или бронхов и 15% с распространенным немелкоклеточным раком легкого (НМРЛ) выживают через год после постановки диагноза.Стандартным лечением первой линии НМРЛ является химиотерапия. Однако появляется все больше свидетельств того, что препараты, называемые ингибиторами тирозинкиназы (TKI), более эффективны, чем химиотерапия, в лечении пациентов с запущенным НМРЛ, у которых есть мутация в гене, известном как EGFR. TKI включают Tarceva, препарат Genentech, одобренный FDA в 2004 году, и Iressa, препарат AstraZeneca, доступный в Японии с 2002 года и в Австралии с 2003 года. Хотя FDA одобрило Tarceva в 2004 году только в качестве терапии второй линии для всех пациентов с НМРЛ, Появляется все больше доказательств того, что TKI, как класс, являются эффективным лечением первой линии для людей с мутацией EGFR.Небольшое исследование, представленное на встрече Американского общества клинической онкологии в июне 2007 года, показало, что 31 пациент с мутацией, которые все получали ирессу в качестве терапии первой линии, имели средний показатель выживаемости 21 месяц.
Рак легких — хороший тому пример. Только 43% всех пациентов с раком легких или бронхов и 15% с распространенным немелкоклеточным раком легкого (НМРЛ) выживают через год после постановки диагноза.Стандартным лечением первой линии НМРЛ является химиотерапия. Однако появляется все больше свидетельств того, что препараты, называемые ингибиторами тирозинкиназы (TKI), более эффективны, чем химиотерапия, в лечении пациентов с запущенным НМРЛ, у которых есть мутация в гене, известном как EGFR. TKI включают Tarceva, препарат Genentech, одобренный FDA в 2004 году, и Iressa, препарат AstraZeneca, доступный в Японии с 2002 года и в Австралии с 2003 года. Хотя FDA одобрило Tarceva в 2004 году только в качестве терапии второй линии для всех пациентов с НМРЛ, Появляется все больше доказательств того, что TKI, как класс, являются эффективным лечением первой линии для людей с мутацией EGFR.Небольшое исследование, представленное на встрече Американского общества клинической онкологии в июне 2007 года, показало, что 31 пациент с мутацией, которые все получали ирессу в качестве терапии первой линии, имели средний показатель выживаемости 21 месяц. Через 12 месяцев 73% пациентов были живы по сравнению с 15% тех, кто следовал традиционному протоколу химиотерапии. Когда лечение Ирессой откладывается и назначается в качестве терапии второй линии, средняя выживаемость существенно не отличается от таковой у пациентов, получающих только химиотерапию, согласно исследованию 2004 года с участием 1000 пациентов.
Через 12 месяцев 73% пациентов были живы по сравнению с 15% тех, кто следовал традиционному протоколу химиотерапии. Когда лечение Ирессой откладывается и назначается в качестве терапии второй линии, средняя выживаемость существенно не отличается от таковой у пациентов, получающих только химиотерапию, согласно исследованию 2004 года с участием 1000 пациентов.
Еще более веские аргументы в пользу того, что Герцептин, моноклональное антитело Genentech, следует использовать с химиотерапией в качестве лечения первой линии для женщин с агрессивной формой рака груди, опухоли которых имеют избыток HER2, белка, способствующего росту клеток. В 1998 году FDA одобрило такое применение Герцептина для HER2-положительных пациентов с метастатическим раком (рак, который распространился на другие части тела) после операции, а в ноябре 2006 года одобрил такое же применение для HER2-положительных пациентов с неметастатический рак молочной железы на ранней стадии.Согласно исследованию 2005 года, в последнем случае Герцептин снизил вероятность метастазирования рака в другие части тела на 53% по сравнению с одной традиционной терапией. Препятствия на пути к персонализированной медицине, о которых мы поговорим позже в этой статье, замедляют использование Герцептина и ИТК для лечения пациентов с соответствующими генетическими профилями.
Препятствия на пути к персонализированной медицине, о которых мы поговорим позже в этой статье, замедляют использование Герцептина и ИТК для лечения пациентов с соответствующими генетическими профилями.
Экономия долларов.
Благодаря раннему выявлению и началу оптимального лечения персонализированная медицина может значительно снизить общие затраты на здравоохранение.Действительно, стоимость диагностических тестов — менее 1000 долларов для подавляющего большинства — бледнеет по сравнению с потенциальными преимуществами. Рассмотрим Герцептин. Тест на обнаружение переизбытка белка HER2 у пациентки с раком груди стоит около 400 долларов. Остаются вопросы контроля качества в отношении того, как лаборатории проводят тест, и вопросы о том, может ли Герцептин также помочь женщинам с более низким уровнем HER2. Тем не менее ясно, что определение того, какие пациенты должны — а какие нет — лечить Герцептин, может сэкономить десятки тысяч долларов на человека: в случае HER2-положительных пациентов, предотвращая метастазирование их рака; в случае HER2-отрицательных пациентов — не лечить их лекарствами, которые им не помогают.
Проблема предоставления лекарств пациентам, которым они не помогают, огромна. Исследования показывают, что большинство лекарств, прописываемых сегодня в США, эффективны менее чем у 60% пролеченных пациентов.
Проблема предоставления лекарств людям, которые не получают от них пользы, огромна. Многочисленные исследования показали, что большинство лекарств, прописываемых сегодня в США, эффективны менее чем у 60% пролеченных пациентов (см. Выставку «Ограничения стандартной лекарственной терапии»), что обходится системе здравоохранения в миллиарды ненужных долларов.Рассмотрим процент пациентов, для которых следующие широко назначаемые классы лекарств, согласно недавнему исследованию, являются либо «неэффективными», либо «не полностью эффективными»: не менее 70% пациентов, принимающих сердечно-сосудистые препараты, известные как ингибиторы АПФ и бета -блокаторы; почти 40% людей назначают антидепрессанты; и по крайней мере 30% пациентов, получавших статины от высокого холестерина, и пациентов, получавших бета- 2 -агонистов от астмы. Диагностических тестов пока не существует, чтобы различать, кто отвечает на эти лекарства, а кто нет, но эта статистика показывает огромную потребность в таких тестах.
Диагностических тестов пока не существует, чтобы различать, кто отвечает на эти лекарства, а кто нет, но эта статистика показывает огромную потребность в таких тестах.
Переход к новой эре
Рост персонализированной медицины является результатом нескольких научных достижений. Секвенирование генома человека помогло исследователям связать растущее число заболеваний с конкретными генами. Кроме того, ученые добились больших успехов в картировании молекулярных путей, с помощью которых изменение или мутация в гене на самом деле проявляется как болезнь. Эти достижения позволили исследователям лекарственных средств разработать диагностические инструменты, которые могут различать подтипы того, что считалось одним заболеванием, а также химические агенты, нацеленные на каждый из них.В результате, многие когда-то смертельные раковые заболевания теперь можно лечить как хронические заболевания, поражая их на ранней стадии.
Возьмите рак крови. В 1920-е годы единственными доступными диагнозами для пациента с синяками, усталостью и ночным потоотделением были лейкемия и лимфома. В течение следующих 20 лет были выявлены три формы лейкемии и два вида лимфомы. Сегодня известно о 38 типах лейкозов и 51 типе лимфомы. Эти достижения в диагностике помогли фармацевтическим компаниям определить целевые методы лечения некоторых из этих подтипов рака.
В течение следующих 20 лет были выявлены три формы лейкемии и два вида лимфомы. Сегодня известно о 38 типах лейкозов и 51 типе лимфомы. Эти достижения в диагностике помогли фармацевтическим компаниям определить целевые методы лечения некоторых из этих подтипов рака.
Например, теперь мы знаем, что аномальный ген, называемый BCR-ABL, вызывает хронический миелоидный лейкоз (ХМЛ), болезнь, от которой ежегодно страдают около 4500 человек в США. Когда диагностический тест определяет, что у пациента есть аномальный ген BCR-ABL, может быть прописан препарат Novartis Gleevec для его связывания и деактивации. Более 95% пациентов с этим типом лейкемии положительно реагируют на начальное лечение Гливеком. Пятилетняя выживаемость пациентов с ХМЛ, получающих Гливек, составляет 89%; до того, как препарат был одобрен в 2001 году, пятилетняя выживаемость пациентов с ХМЛ составляла всего 69%.Такие открытия объясняют, почему смертность от рака снизилась как в 2003, так и в 2004 году, в самые последние годы, по которым имеются данные, и почему показатели выживаемости от некоторых видов рака улучшаются более чем на десятилетие.
Прогресс в знаниях о том, как люди усваивают лекарства, также является ключом к персонализированной медицине. Они дают гораздо более точное понимание того, почему люди по-разному реагируют на одно и то же лекарство. Около 30 различных ферментов, каждый из которых вырабатывается отдельным геном или набором генов, контролируют метаболизм лекарств человеком.Вариация, наличие или отсутствие любого из этих генов может повлиять как на минимальную дозу, которая будет эффективной, так и на максимальную дозу, которую индивидуум может переносить, не испытывая побочных реакций. Сегодня доступны тесты для выявления многих генетических различий, позволяющие изменять дозировку лекарств. К сожалению, эти тесты недостаточно используются, что приводит к ненужным побочным реакциям на лекарства и миллиардам долларов, которых можно избежать. Одним из показательных примеров является варфарин, широко назначаемый антикоагулянт.По оценкам FDA, если диагностические тесты для выявления определенных вариаций генов будут регулярно назначаться пациентам, нуждающимся в варфарине, то уменьшение серьезных кровотечений и инсультов, вызванных недостаточной или передозировкой препарата, может спасти систему здравоохранения США. 1,1 миллиарда долларов в год. (См. Врезку «Недоиспользованный прорыв».)
1,1 миллиарда долларов в год. (См. Врезку «Недоиспользованный прорыв».)
Персонализированная медицина — это не только подбор оптимальных лекарств и дозировок. При некоторых формах рака диагностические тесты могут помочь врачу определить агрессивность опухоли и, в конечном итоге, решить, проводить ли операцию или использовать менее инвазивные методы лечения.Например, клинические исследования теперь показали, что если в раке простаты отсутствуют гены, вызывающие агрессивную форму рака, он может оставаться стабильным в предстательной железе в течение десятилетий, устраняя необходимость в радикальной хирургической резекции, лучевой терапии и химиотерапии.
Количество заболеваний, которые можно точно диагностировать, а затем лечить с помощью высокоспецифической терапии, несомненно, резко увеличится в течение десятилетия. За последние пять лет количество онкологических препаратов для пациентов с определенными генетическими характеристиками вырос примерно с 10% до более 40% по сравнению с лекарствами, участвующими в клинических испытаниях (первая, вторая и третья фазы). Хотя диагностика и лечение рака находятся на переднем крае прогресса в этой области, аналогичные разработки происходят и в других медицинских областях. Например, поскольку вирус ВИЧ может быстро мутировать, стандартная помощь в связи с ВИЧ теперь включает регулярное тестирование для определения текущего генетического состава вируса пациента, а затем соответствующий подбор лекарственной терапии. В будущем одна из особенно многообещающих областей — сердечно-сосудистые заболевания. Исследователи делают успехи в выявлении генетических вариантов у пациентов, которые не реагируют на определенные препараты для лечения высокого кровяного давления и сердечной недостаточности (ингибиторы АПФ, бета-блокаторы, блокаторы кальциевых каналов и диуретики).
Хотя диагностика и лечение рака находятся на переднем крае прогресса в этой области, аналогичные разработки происходят и в других медицинских областях. Например, поскольку вирус ВИЧ может быстро мутировать, стандартная помощь в связи с ВИЧ теперь включает регулярное тестирование для определения текущего генетического состава вируса пациента, а затем соответствующий подбор лекарственной терапии. В будущем одна из особенно многообещающих областей — сердечно-сосудистые заболевания. Исследователи делают успехи в выявлении генетических вариантов у пациентов, которые не реагируют на определенные препараты для лечения высокого кровяного давления и сердечной недостаточности (ингибиторы АПФ, бета-блокаторы, блокаторы кальциевых каналов и диуретики).
Конечно, после выявления связи между геном и заболеванием разработка диагностического теста для этого гена требует времени. Даже когда такие тесты коммерчески доступны, рутинное использование не является обязательным. Чтобы достичь этого, необходимо преодолеть четыре препятствия на пути к персонализированной медицине.
Понимание препятствий
Как часто бывает с появлением любой новой парадигмы, сильные и могущественные укоренившиеся силы работают против принятия персонализированной медицины в Соединенных Штатах.
Фармацевтическая промышленность.
Разработанная за последние 50 лет бизнес-модель блокбастеров и наркотиков оказалась весьма успешной. Когда дела идут хорошо, это дает эффективную терапию для миллионов и высокодоходный продукт. Действительно, финансовые показатели фармацевтической отрасли исторически были одними из самых высоких среди всех отраслей не только в США, но и во всем мире.
Однако многие индикаторы предполагают, что дни этой модели-блокбастера сочтены.Во-первых, идентификация и разработка новых методов лечения становится все труднее: несмотря на то, что общие расходы на НИОКР фармацевтической промышленности и федерального правительства утроились (в реальном выражении) с 1990 года, количество новых молекулярных объектов, или NME, одобренных FDA количество используемых в качестве наркотиков снизилось с 33 в год в 1993–1997 годах до 26 в 1998–2003 годах. Более того, все большее количество NME являются целевыми в своем действии, а это означает, что они эффективны при лечении только субпопуляций людей с данным заболеванием.
Более того, все большее количество NME являются целевыми в своем действии, а это означает, что они эффективны при лечении только субпопуляций людей с данным заболеванием.
В результате крупные фармацевтические компании не смогли создать достаточно новых лекарств, чтобы компенсировать снижение продаж блокбастеров, выходящих из-под патентов, не говоря уже о том, чтобы оправдать ожидания Уолл-Стрит в отношении постоянного роста. Этот дефицит спровоцировал волну консолидации отрасли, поскольку компании прибегали к приобретениям, чтобы заполнить свои продуктовые линейки и увеличить прибыль за счет большей экономии на масштабе. Однако подавляющее большинство традиционных фармацевтических гигантов не хотели отказываться от модели блокбастеров и сосредоточились на разработке большего числа лекарств с гораздо более ограниченным рыночным потенциалом.На самом деле, они часто выбирают , а не , чтобы разработать таргетную терапию.
Кроме того, крупные фармацевтические компании, как правило, тускло относятся к лекарствам, связанным с диагностикой, опасаясь, что диагностический компонент усложнит маркетинг для врачей и замедлит идентификацию пациентов, нуждающихся в лечении, добавив еще один шаг в процесс диагностики. . В результате лишь немногие фармацевтические компании приняли диагностику в качестве важнейшего компонента своих исследований, клинических испытаний и коммерциализации.Даже когда диагностика была частью НИОКР, большинство фармацевтических компаний не хотели, чтобы FDA призывало или требовало от врачей проведения диагностических тестов, прежде чем они выпишут лекарство.
. В результате лишь немногие фармацевтические компании приняли диагностику в качестве важнейшего компонента своих исследований, клинических испытаний и коммерциализации.Даже когда диагностика была частью НИОКР, большинство фармацевтических компаний не хотели, чтобы FDA призывало или требовало от врачей проведения диагностических тестов, прежде чем они выпишут лекарство.
FDA.
Это агентство требует от фармацевтических компаний проведения все более крупных и подробных клинических испытаний, чтобы доказать безопасность и эффективность новых лекарств. Эти большие клинические испытания значительно увеличивают затраты на разработку лекарств.
Рассмотрим новый препарат, который был бы безопасным и эффективным для 25% населения с определенным заболеванием, но неэффективным или потенциально опасным для остальных 75%.Крупномасштабное клиническое испытание препарата на всей популяции с заболеванием не только будет дорогостоящим, но и даст результаты, которые вряд ли позволят получить одобрение препарата FDA. Однако гораздо меньшее испытание, направленное только на 25%, в котором используется генетический тест для определения подходящих участников, даст сильные положительные результаты.
Однако гораздо меньшее испытание, направленное только на 25%, в котором используется генетический тест для определения подходящих участников, даст сильные положительные результаты.
Хотя FDA в принципе заявило о поддержке персонализированной медицины, его действия отстают от его слов. Даже в тех случаях, когда конкретный диагностический тест использовался в качестве критерия для включения участников испытания препарата, агентство лишь изредка требовало от врачей проведения теста перед назначением препарата.Хорошим примером является Весаноид Рош, который эффективен при лечении острого промиелоцитарного лейкоза (APL), заболевания, определяемого определенным генетическим маркером. На этикетке, одобренной FDA, указано, что везаноид был изучен на пациентах с маркером, и врачи должны рассмотреть альтернативное лечение для пациентов, у которых его нет. Однако эта формулировка носит чисто информационный характер. FDA не требует наличия доступного теста на биомаркеры, хотя примерно 25% пользователей Vesanoid могут страдать от потенциально смертельного синдрома, характеризующегося лихорадкой, острым респираторным дистресс-синдромом и полиорганной недостаточностью. Кажется абсурдным подвергать этому риску людей, не желающих получить пользу от препарата.
Кажется абсурдным подвергать этому риску людей, не желающих получить пользу от препарата.
Что еще хуже, FDA не имеет системы для тщательного отслеживания и изучения воздействия назначения лекарств вне установленных показаний. Такая система не только остановит потенциально опасное использование не по назначению, но также поможет быстрее выявлять полезные применения не по назначению — например, использование ингибиторов тирозинкиназы при лечении пациентов с немелкоклеточным раком легкого с мутацией гена EGFR. которые мы обсуждали ранее.
Возмещение.
Восемьдесят процентов всех счетов за медицинское обслуживание в США оплачиваются программами Medicare, Medicaid или страховкой, предоставляемой работодателем. К сожалению, система компенсации, контролируемая этими учреждениями, оплачивает — и, таким образом, поощряет — выполнение процедур, а не точный диагноз.
Сегодняшний платный подход основан на существующей системе кодов процедурной терминологии (CPT), которую Американская медицинская ассоциация разработала для центров услуг Medicare и Medicaid (CMS) в 1966 году. Процесс утверждения CPT контролируется комитетом AMA и его консультативными советами, состоящими из более чем 90 врачей, назначенных национальными медицинскими обществами. Индустрия диагностики не представлена в комитете или его советах. Поскольку приоритетом врачей в комитетах и советах является уровень компенсации за лечение по их специальностям и поскольку процесс добавления, удаления или изменения кодов является длительным и трудоемким, коды CPT и сборы, связанные с диагностическим тестированием, обновляются редко.Цены повышались из-за инфляции только дважды за последние 15 лет, но вряд ли это самая большая проблема. Если будет разработана новая методика, которая сокращает количество необходимых лабораторных работ, скажем, с восьми до шести, плата соответственно сокращается. Когда новый диагностический тест требует новой лабораторной деятельности, для которой не существует кода CPT, лаборатория, выполняющая тест, имеет три непривлекательных варианта: не принимать возмещения за деятельность, попытаться обосновать, почему новая деятельность должна быть возмещена в соответствии с существующий код, который не соответствует действию, или начать долгий процесс создания нового кода.
Процесс утверждения CPT контролируется комитетом AMA и его консультативными советами, состоящими из более чем 90 врачей, назначенных национальными медицинскими обществами. Индустрия диагностики не представлена в комитете или его советах. Поскольку приоритетом врачей в комитетах и советах является уровень компенсации за лечение по их специальностям и поскольку процесс добавления, удаления или изменения кодов является длительным и трудоемким, коды CPT и сборы, связанные с диагностическим тестированием, обновляются редко.Цены повышались из-за инфляции только дважды за последние 15 лет, но вряд ли это самая большая проблема. Если будет разработана новая методика, которая сокращает количество необходимых лабораторных работ, скажем, с восьми до шести, плата соответственно сокращается. Когда новый диагностический тест требует новой лабораторной деятельности, для которой не существует кода CPT, лаборатория, выполняющая тест, имеет три непривлекательных варианта: не принимать возмещения за деятельность, попытаться обосновать, почему новая деятельность должна быть возмещена в соответствии с существующий код, который не соответствует действию, или начать долгий процесс создания нового кода. Даже если лаборатории удастся получить новый код CPT, это не гарантия того, что CMS оплатит тест.
Даже если лаборатории удастся получить новый код CPT, это не гарантия того, что CMS оплатит тест.
Итог: у компаний мало стимулов для разработки новых диагностических тестов или повышения эффективности и действенности существующих.
Привычки врачей.
Некоторые явления мешают даже самым доброжелательным врачам принять индивидуализированную медицину. Только что обсужденная система возмещения расходов одна. Он вознаграждает врачей за процедуры и недооценивает время и усилия, необходимые для постановки точного диагноза.Если диагноз не может быть установлен за одно посещение, необходимое время превышает компенсацию. Кроме того, если диагностический тест не может быть проведен в кабинете врача, у врача нет финансовых стимулов для его заказа. Тем не менее, практически все тесты, связанные с персонализированной медициной, сложны и должны (по крайней мере сегодня) проводиться вне кабинета врача.
Большая часть из 700000 практикующих врачей США также не понимает проблем персонализированной медицины. Большинство из них получили медицинское образование до революции в геномике.Задача обучения критической массы такого большого и фрагментированного сообщества новой парадигме огромна. Кроме того, большинство медицинских школ еще не полностью включили генетику и геномику в свои учебные программы.
Большинство из них получили медицинское образование до революции в геномике.Задача обучения критической массы такого большого и фрагментированного сообщества новой парадигме огромна. Кроме того, большинство медицинских школ еще не полностью включили генетику и геномику в свои учебные программы.
Наконец, медицинские организации исторически неохотно занимали решительную, активную позицию, рекомендуя новые стандарты оказания помощи. Учитывая количество стандартов, которые врачи уже должны соблюдать, профессиональные организации обеспокоены тем, что излишне увеличивают нагрузку на врачей, чрезмерно ограничивают их свободу решать, что лучше для пациентов, и делают их более уязвимыми для исков о халатности.
Такие проблемы помогают объяснить, почему для широкого использования новых тестов и методов лечения для субпопуляций требуется так много времени. Рассмотрим ранее обсуждавшийся тест на белок HER2 на рак груди. Несмотря на то, что скорость, с которой врачи применяют его, была относительно высокой, многие врачи все еще не используют его в качестве части первоначальной диагностики.
Преодоление барьеров
Существуют конкретные практические способы преодоления каждого из барьеров, с которыми сталкивается персонализированная медицина, некоторые из которых относительно простые, а другие чрезвычайно сложные.
Трансформирующиеся фармацевтические гиганты.
Крупные фармацевтические компании могут предпринять три шага для ускорения внедрения персонализированной медицины: отказаться от бизнес-модели блокбастеров, создать альянсы с диагностическими компаниями и активизировать усилия по информированию о преимуществах безопасности и эффективности таргетных методов лечения.
Трудно преувеличить задачу изменения бизнес-модели фармацевтических гигантов с блокбастеров на индивидуальные методы лечения. Это будет означать переход от менталитета большого шлема (создание горстки лекарств, которые могут приносить годовой объем продаж в 1 миллиард долларов или более каждый) к тому, который делает упор на одиночные, двойные и случайные тройные игры (создание большего портфеля от 200 миллионов до 500 долларов. продавцов-миллионников в год).
продавцов-миллионников в год).
Переход к целевой модели, вероятно, приведет к сокращению продаж и прибыли в краткосрочной перспективе, поскольку компании запускают программы биомаркеров, диагностики и других исследований. Однако в среднесрочной и долгосрочной перспективе бизнес-модель, нацеленная на лекарства, увеличит продажи и прибыль по нескольким причинам:
Субпопуляция может оказаться не такой уж и маленькой.
Как только становится доступным высокоэффективное лечение заболевания, большее количество больных обращаются к своим врачам, которые узнают о лечении и готовы его предоставить.Кроме того, некоторые исследования и неофициальные данные свидетельствуют о том, что знание о большей эффективности таргетной терапии повышает вероятность того, что пациенты будут придерживаться своих схем приема лекарств.
Плательщики начинают осознавать реальную и растущую стоимость введения неэффективных лекарств и лечения побочных эффектов.
В результате, если фармацевтическая компания сможет продемонстрировать, что ее лекарство снижает общие затраты на лечение подгруппы населения с заболеванием, частные и государственные страховщики будут все более охотно платить за соответствующий диагностический тест и платить более высокую цену за лекарство. лечение.
лечение.
Сосредоточение клинических испытаний на целевых подгруппах населения сократит их размер, продолжительность и стоимость.
Поскольку на клинические испытания сейчас тратится больше половины денег, потраченных на разработку лекарств, это изменение повысит прибыльность лекарств.
У крупных фармацевтических компаний нет другого выбора, кроме как меняться. Тех, кто придерживается модели блокбастеров, ждет разочаровывающее будущее, связанное с падением продаж и прибылей.
Однако для достижения этих преимуществ крупные фармацевтические компании должны использовать бизнес-модель, которая включает диагностику при разработке лекарств, дизайн испытаний и, в конечном итоге, лечение пациентов.Те, кто это сделает, не только улучшат свои финансовые показатели в долгосрочной перспективе, но и заработают добрую волю пациентов и общества в целом. Учитывая тенденции, у крупных фармацевтических компаний нет другого выбора, кроме как меняться. Тех, кто придерживается модели блокбастеров, ждет разочаровывающее будущее, связанное с падением продаж и прибылей.
Постановление о капитальном ремонте.
За последние три года FDA начало поддерживать принципы персонализированной медицины. Агентство сделало создание руководств по совместной разработке диагностических тестов и лекарств элементом своей инициативы «Критический путь».«Кроме того, он работает с фармацевтическими и диагностическими компаниями над созданием формального процесса проверки тестов на биомаркеры. Как долго эти усилия принесут плоды, еще неизвестно. Тем временем в США и других странах необходимо сделать больше. (Например, европейские агентства находятся примерно в том же месте, что и FDA. Они также изучают, как включить биомаркеры и другие диагностические тесты в нормативные положения о лекарственных средствах, но еще не приняли официальной политики.)
FDA должно стимулировать фармацевтические компании к совместной разработке диагностических и целевых препаратов.Одним из простых стимулов было бы ускорить рассмотрение всех новых лекарств, которые включают диагностический тест как часть процесса отбора пациентов. Чем быстрее лекарство и тест будут одобрены, тем скорее лечение попадет к пациентам и тем быстрее производители получат финансовую выгоду.
Чем быстрее лекарство и тест будут одобрены, тем скорее лечение попадет к пациентам и тем быстрее производители получат финансовую выгоду.
Что еще более важно, когда лекарство и диагностический тест разрабатываются и проходят клинические испытания вместе, FDA должно единообразно требовать, чтобы тест проводился и его результаты рассматривались до назначения лечения.Эти тесты должны включать те, которые определяют, как пациенты метаболизируют определенные лекарства. Сегодня до 10% этикеток лекарств содержат информацию о том, как генетические вариации влияют на реакцию людей на лекарства. Однако очень немногие упоминают тесты, которые можно использовать для получения и интерпретации этих данных для отдельных пациентов, не говоря уже о том, чтобы они проводились для определения оптимальных дозировок лекарств.
Наконец, крайне важно, чтобы FDA разработало соответствующие стандарты для обеспечения точности и целостности диагностических тестов.Агентству необходимо внедрить практические правила, которые продолжают поощрять отраслевые инновации, но поддерживают высокие стандарты качества. При правильном исполнении такие правила повысят доверие как врачей, так и пациентов к персонализированной медицине.
При правильном исполнении такие правила повысят доверие как врачей, так и пациентов к персонализированной медицине.
Плата за производительность.
Самым влиятельным из всех плательщиков в Соединенных Штатах являются Центры услуг Medicare и Medicaid, которые напрямую возмещают 34% всей медицинской помощи и чьей структуре подражают большинство других плательщиков США.Исторически FDA и CMS работали независимо. Однако, работая вместе, эти агентства могут многое сделать для развития персонализированной медицины. Непосредственной возможностью являются новые стандарты оплаты за производительность, которые CMS создает. FDA вместе с врачебными сообществами должно разработать стандарты для надлежащего использования диагностических тестов, а CMS должна возмещать поставщикам в зависимости от того, насколько хорошо они соблюдают эти стандарты. Таким образом, CMS будет вознаграждать за отличную диагностику, а не только за лечение.К сожалению, первоначальные проекты руководств по оплате труда не включают положений о диагностических тестах.
Кроме того, FDA и CMS должны координировать свои усилия по оценке эффективности лекарства после того, как оно одобрено и поступит на рынок. Сегодня FDA оценивает безопасность и эффективность препарата, а CMS отдельно оценивает рентабельность препарата. В результате эти два агентства придерживаются пересекающихся и непоследовательных политик, что замедляет темпы изменений. Вот изменение, которое будет иметь большое значение: CMS уже показала, что будет оплачивать целевые лекарственные препараты по относительно высокой ставке только в том случае, если их эффективность на рынке будет полностью отслеживаться и анализироваться.Чтобы придать этой политике основу, FDA должно постоянно включать на этикетках лекарств требование о том, чтобы диагностика, если таковая имеется, использовалась для выбора подходящих пациентов для лечения. Тогда было бы разумно, чтобы CMS сделала доказательство тестирования предпосылкой для возмещения расходов на лекарства.
Наконец, необходимо реформировать систему возмещения стоимости диагностики с помощью кода CPT. Согласно модели, которую мы представляем, диагностика и лечение будут разделены на финансовое вознаграждение. Врачам будет выплачиваться компенсация за использование соответствующих современных диагностических тестов.Лабораториям, проводящим тесты, будет выплачиваться оплата в соответствии с их стоимостью в помощи врачам в постановке точных диагнозов, что позволит лабораториям получать справедливую прибыль и поддерживать текущие исследования и обучение. Фармацевтическим компаниям будет разрешено взимать плату за чрезвычайно эффективные целевые лекарства, которые в противном случае могли бы показаться высокими. Эти радикальные реформы будет нелегко и быстро провести, но они являются критически важными шагами на пути к полному внедрению персонализированной медицины.
Согласно модели, которую мы представляем, диагностика и лечение будут разделены на финансовое вознаграждение. Врачам будет выплачиваться компенсация за использование соответствующих современных диагностических тестов.Лабораториям, проводящим тесты, будет выплачиваться оплата в соответствии с их стоимостью в помощи врачам в постановке точных диагнозов, что позволит лабораториям получать справедливую прибыль и поддерживать текущие исследования и обучение. Фармацевтическим компаниям будет разрешено взимать плату за чрезвычайно эффективные целевые лекарства, которые в противном случае могли бы показаться высокими. Эти радикальные реформы будет нелегко и быстро провести, но они являются критически важными шагами на пути к полному внедрению персонализированной медицины.
Изменение привычек врачей.
Предложенные выше изменения устранят многие из экономических препятствий, которые отговаривают врачей заказывать все необходимые диагностические тесты. Тогда изменение привычек врачей будет в основном вопросом образования. К счастью, большинство врачей уже обязаны посещать от 12 до 50 часов курсов непрерывного медицинского образования (НМО) в год, чтобы сохранить свои лицензии. Однако очень немногие государства оговаривают конкретное содержание этих курсов. Чтобы врачи быстрее узнали о персонализированной медицине, штаты должны потребовать, чтобы определенная часть необходимых кредитов CME была сосредоточена на геномике, диагностическом тестировании и целенаправленной терапии.Одно только это изменение сыграет решающую роль в продвижении персонализированной медицины в основную практику.
К счастью, большинство врачей уже обязаны посещать от 12 до 50 часов курсов непрерывного медицинского образования (НМО) в год, чтобы сохранить свои лицензии. Однако очень немногие государства оговаривают конкретное содержание этих курсов. Чтобы врачи быстрее узнали о персонализированной медицине, штаты должны потребовать, чтобы определенная часть необходимых кредитов CME была сосредоточена на геномике, диагностическом тестировании и целенаправленной терапии.Одно только это изменение сыграет решающую роль в продвижении персонализированной медицины в основную практику.
Будет легче обучать будущие поколения врачей. Однако, чтобы это произошло, медицинские вузы должны предпринять несколько шагов. Им нужно больше сосредоточиться на важности точной диагностики и науки о диагностике. Они должны лучше включать генетику и геномику в свои учебные программы, чтобы учащиеся понимали основную науку и ее применение в диагностических и терапевтических инструментах.Наконец, школам необходимо предоставлять больше стипендий в области геномной медицины, что помогло бы закрепить эту область в качестве узкой специальности.
Медицинские организации, которые во многих недавних дебатах по поводу расширенного использования диагностики и персонализированной медицины в основном молчали, должны стать активными защитниками. Им следует активно участвовать в разработке новых стандартов медицинской помощи, которые объединяют новые методы лечения, диагностики и стандарты качества для тестирования. Такие стандарты необходимы для ускорения внедрения врачами персонализированной медицины, а также для реформирования системы возмещения расходов.• • •
Работодатели США могут помочь ускорить темпы изменений несколькими практическими способами. Они могут подтолкнуть страховщиков к покрытию целевого лечения, включая диагностику, и настаивать на том, чтобы поставщики услуг регулярно предлагали их своим сотрудникам. Они могут потребовать, чтобы страховщики, стремясь контролировать расходы, сосредоточили внимание на общих расходах на лечение в течение всего периода болезни, а не только на затратах на начальные процедуры.
Да, медленный прогресс персонализированной медицины в последнее десятилетие разочаровывает, но это неудивительно, учитывая сложность системы здравоохранения со всеми ее корыстными интересами.Смена парадигмы редко происходит быстро. Рассмотрим производственную систему Toyota, которая была аналогичным революционным движением, направленным на то, чтобы «сделать все правильно с первого раза». Производителям за пределами Японии понадобилось 30 лет, чтобы признать превосходство этого подхода. Учитывая, что персонализированная медицина ставит более высокие ставки — жизни людей и жизнеспособность систем здравоохранения — было бы бессовестным допускать, чтобы широкое внедрение персонализированной медицины длилось так же долго.
От ажиотажа к реальности: наука о данных делает возможным персонализированную медицину | BMC Medicine
Машинное обучение для персонализированной медицины
Определение лучших клинических конечных точек
Многие методологические, а также прикладные статьи сосредоточены на простых задачах принятия решений «да / нет», например. g., прогрессирование заболевания / отсутствие прогрессирования заболевания или конечная точка клинического исследования достигнута / не достигнута. Это удивительно, потому что исследования в области машинного обучения предлагают обширный арсенал методов для решения клинических конечных точек за пределами бинарной классификации, таких как реальная оценка, время до события, многоклассовые или многомерные результаты. Модели с бинарными исходами могут быть подходящими в конкретных ситуациях, но во многих случаях соответствующий клинический исход является более сложным. Например, обычно используемый критерий ответа на ревматоидный артрит, изнурительное аутоиммунное заболевание суставов, основан на шкале болезни DAS28 [26], которая колеблется по непрерывной шкале от 0 до 10 и часто дискретизируется на три последовательных уровня ( низкая, средняя, высокая активность заболевания).
g., прогрессирование заболевания / отсутствие прогрессирования заболевания или конечная точка клинического исследования достигнута / не достигнута. Это удивительно, потому что исследования в области машинного обучения предлагают обширный арсенал методов для решения клинических конечных точек за пределами бинарной классификации, таких как реальная оценка, время до события, многоклассовые или многомерные результаты. Модели с бинарными исходами могут быть подходящими в конкретных ситуациях, но во многих случаях соответствующий клинический исход является более сложным. Например, обычно используемый критерий ответа на ревматоидный артрит, изнурительное аутоиммунное заболевание суставов, основан на шкале болезни DAS28 [26], которая колеблется по непрерывной шкале от 0 до 10 и часто дискретизируется на три последовательных уровня ( низкая, средняя, высокая активность заболевания).
Сама оценка DAS28 объединяет четыре компонента в нелинейное уравнение, а именно количество опухших суставов, количество болезненных суставов, уровни белка CRP в плазме и оценку общего состояния здоровья пациента по оценке врача. Эти компоненты варьируются от дискретных до непрерывных и от субъективных оценок, зависящих от врача, до более объективных измерений биомаркеров.
Другой пример — прогнозирование ответа на лечение противоэпилептическими препаратами.Хотя на первый взгляд общее снижение частоты приступов через определенное количество недель относительно исходного уровня кажется подходящей конечной точкой в соответствии с общей практикой клинических испытаний, этот выбор фактически не учитывает существование различных типов приступов, а также возможные временные изменения. этих типов приступов из-за лечения. Таким образом, могут потребоваться другие, более сложные (возможно, многомерные) клинические конечные точки. Мы ожидаем, что более тщательный выбор клинических конечных точек, а также улучшенные возможности технического мониторинга (например,g., через мобильные медицинские приложения и носимые датчики) приведет к созданию более клинически полезных моделей прогнозирования в будущем.
Определение подходящего качества модели и показателей производительности
Что делает модель хорошей в персонализированной медицине? Во-первых, прогнозы должны быть точными. Как указывалось выше, точность прогноза должна оцениваться с помощью подхода тщательной проверки. В рамках такой процедуры проверки необходимо решить, как будут измеряться характеристики прогнозирования. Похоже, что во многих исследованиях слишком много внимания уделяется стандартным стандартным метрикам (например,g., площадь под характеристической кривой оператора приемника) по сравнению с показателями производительности для конкретного приложения. Например, рассмотрим случай прогнозирования ответа на терапию первой линии и предположим, что мы можем сформулировать этот вопрос как задачу классификации (отвечающий или не отвечающий). Ясно, что идеально точный классификатор является оптимальным. Однако даже классификатор, который является посредственным в отношении общей точности, может надежно идентифицировать тех пациентов, которые определенно не ответят на препарат.Выявленные пациенты могут немедленно перейти к терапии второй линии, и, таким образом, качество жизни пациентов улучшится, а расходы на здравоохранение могут быть снижены. Этот пример демонстрирует важность тщательного определения соответствующих показателей эффективности прогнозирования.
Однако производительность прогнозирования — это только один аспект оценки общего качества модели. Другой аспект — стабильность модели, которая отражает степень, в которой модель (включая переменные, выбранные этой моделью) остается неизменной, если обучающие данные немного изменены.Стабильность модели представляет собой особую проблему при работе с данными экспрессии генов, когда модели, обученные на очень разных или даже непересекающихся подмножествах генов, могут привести к аналогичной эффективности прогнозирования в отношении данной клинической конечной точки, поскольку сильно коррелированные признаки могут быть заменены друг на друга [26]. В дополнение к прогнозным характеристикам следует регулярно сообщать о стабильности модели.
Были разработаны различные методы для увеличения шансов получения стабильной модели на этапе разработки алгоритма стратификации.Например, включение предшествующих знаний, таких как биологические сети и пути, может повысить стабильность и, таким образом, воспроизводимость сигнатур экспрессии генов [27,28,29]. Более того, регрессия с нулевой суммой [30] может использоваться для построения классификаторов, которые в меньшей степени зависят от используемой платформы omics (например, конкретной микросхемы микроматрицы) [31], что упрощает внешнюю валидацию, перевод в клиническую практику, а также длительный срок службы. срок применимости модели. Мы думаем, что более частое использование такой методологии в сочетании с тщательной оценкой стабильности модели снизит барьер для перехода модели от открытия к внешней проверке и, наконец, к клиническому применению.
Инструменты для интерпретации модели машинного обучения
По мере того, как исследователи собирают и анализируют все более обширные наборы данных, для обучения прогнозных моделей используется все большее количество сложных алгоритмов. Некоторые вычислительные методы, в частности основанные на методах глубокого обучения, часто критикуют за то, что они являются черными ящиками. Действительно, по мере того, как количество входных функций становится большим, а вычислительный процесс усложняется, понимание причин для получения конкретного результата становится трудным, если не невозможным.Однако во многих случаях, например, в случае идентификации маркеров болезни, понимание вычислительного процесса принятия решений, ведущего к выбору конкретных маркеров, необходимо и требуется врачами. Таким образом, использование моделей черного ящика для принятия медицинских решений часто считается проблематичным, что приводит к таким инициативам, как статья 22 Закона о «праве на объяснение» Общего регламента защиты данных, предложенного Европейским союзом в апреле 2016/679. Аналогичным образом, в процессе разработки лекарств в фармацевтической промышленности регулирующие органы требуют прозрачности и подтверждающих данных о молекулярном механизме выбора конкретных панелей биомаркеров.
В то время как полезность прогнозирования на основе данных получает все большее признание, ключевым требованием для достоверности таких решений, таким образом, является способность интерпретировать их в контексте современных биомедицинских знаний. Важно понимать, что понятие интерпретируемости охватывает спектр (рис. 4). На одном конце спектра находится подробное понимание точных (биохимических) молекулярных и патофизиологических механизмов, которые связывают модель с определенной клинической конечной точкой.Как правило, такой уровень понимания редко достигается из-за недостатка знаний.
Рис. 4Различные классы моделей машинного обучения и их интерпретируемость посредством анализа моделей
Менее подробный уровень понимания — это общий причинно-следственный эффект предсказателя в отношении интересующей клинической конечной точки. Например, в рандомизированном контролируемом клиническом исследовании любая разница в результатах между двумя группами лечения, как известно, вызвана лечением (поскольку группы схожи во всех других отношениях из-за рандомизации).Таким образом, хотя человек может не знать точно, как лечение влияет на результат, он знает, что это так. Такие заявления об общих причинно-следственных связях труднее получить в условиях вне клинических испытаний, когда собираются чисто наблюдательные данные от нелеченных пациентов (например, данные поперечной экспрессии генов). Тем не менее, вычислительные подходы в этой области за последние годы значительно продвинулись вперед и, при определенных допущениях и условиях, позволяют оценивать причинные эффекты непосредственно на основе данных наблюдений [32, 33].
На более низком уровне интерпретируемости методы анализа набора генов и молекулярных сетей [34, 35] могут помочь понять биологические подсистемы, в которых задействованы биомаркеры, выбранные алгоритмом машинного обучения. Также существует большое количество литературы о том, как напрямую включить информацию о биологических сетях вместе с данными экспрессии генов в алгоритмы машинного обучения (см. Обзор в [28]).
Недавно концепция «карт болезней» была разработана как инструмент сообщества для преодоления разрыва между экспериментальными биологическими и компьютерными исследованиями [36].Карта болезни — это визуальное, управляемое компьютером и стандартизированное представление полученных из литературы причинно-следственных связей между генетическими вариантами, генами, биологическими процессами, клиническими исходами или другими интересующими объектами. Карты заболеваний могут использоваться для визуализации предшествующих знаний и предоставления платформы, которая может помочь понять предикторы в модели машинного обучения в контексте патогенеза заболевания, сопутствующих заболеваний и потенциальных реакций на лекарства. Ряд редакторов визуальных путей, таких как CellDesigner [37] и PathVisio [38], используются для отображения содержимого карты болезней и предлагают инструменты для регулярного обновления и глубокого аннотирования хранилищ знаний.Кроме того, сообществом Disease Map были разработаны специальные инструменты, такие как MINERVA [39] и NaviCell [40]. На данный момент карты болезней представляют собой в большей степени инструменты управления знаниями, чем моделирование или моделирование, хотя прилагаются активные усилия по разработке следующего поколения карт болезней, которые будут полезны для математического моделирования и моделирования и станут неотъемлемой частью конвейеров интерпретации данных.
Наименее подробный уровень понимания сложного алгоритма машинного обучения обеспечивается анализом относительной важности переменных в отношении прогнозов модели.Относительную важность переменных можно вычислить для ряда современных моделей машинного обучения (включая методы глубокого обучения), но уровень понимания зависит от того, имеют ли только несколько из всех переменных выдающуюся релевантность и можно ли контекстуализировать эти переменные с помощью подтверждающих данных из литература. Также не ясно априори, коррелируют ли такие переменные только с интересующим результатом или, возможно, также являются их причинными. Наконец, проверка наиболее важных переменных может быть менее информативной в случае сильно коллинеарных зависимостей между переменными-предикторами, такими как, например, в данных экспрессии генов.
Помимо интерпретации предикторов, с точки зрения врача, необходимо лучше понимать предсказания и результаты модели для данного пациента. Один из очевидных способов — показать пациентов с похожими характеристиками. Однако результат будет зависеть от точного математического определения подобия. Более того, клинические исходы у большинства похожих пациентов, как правило, не всегда совпадают с прогнозами, сделанными с помощью сложных моделей машинного обучения, что может привести к неверной интерпретации.Та же общая проблема касается подходов, в которых сложная модель машинного обучения аппроксимируется более простой для повышения интерпретируемости, например, с использованием дерева решений [41, 42].
Проблемы и решения для конкретных типов данных
Продольные данные из реального мира
Продольные данные EMR и претензий в последние годы вызывают растущий интерес в области персонализированной медицины [43, 44], поскольку они дают менее предвзятый взгляд на пациента траектории, чем данные классических клинических испытаний, которые всегда подлежат определенным критериям включения и исключения [45].В частности, в Соединенных Штатах выросла целая индустрия для сбора, аннотирования и анализа реальных продольных данных (https://cancerlinq.org/about, https://truvenhealth.com/). Недавнее приобретение Flatiron Health за 1,9 млрд долларов США фармацевтической компанией Roche (https://www.roche.com/media/store/releases/med-cor-2018-02-15.htm) знаменует собой потенциал, который видит лица, принимающие решения в промышленности в контексте разработки лекарств, фармаконадзора, расширения ассортимента и постмаркетингового анализа [45, 46].
Продольные данные реального мира создают определенные проблемы для обучения и проверки прогнозных моделей. В рамках анализа клинических баз данных реального мира (например, Clinical Practice Research Datalink; https://www.cprd.com/home/) пациенты для когорты исследования обычно отбираются на основе определенной даты индекса или события, которое часто трудно определить, и поэтому остается место для различных вариантов. Поскольку максимальный горизонт наблюдения в реальных базах данных часто ограничивается определенным числом лет (например,g., из-за бюджетных ограничений) одни пациенты наблюдаются дольше, чем другие. В частности, данные о претензиях могут содержать пробелы (например, из-за периодов безработицы пациентов), а точная дата диагноза, назначения или медицинской процедуры не может быть однозначно определена. Лечащему врачу не всегда ясно, какой код диагностики по МКБ выбрать, и это оставляет место для оптимизации с точки зрения финансовых результатов. Кроме того, для EMR требуется предварительная обработка естественного языка с помощью интеллектуального анализа текста, что само по себе является сложной и потенциально подверженной ошибкам процедурой.В заключение следует отметить, что разработка прогнозной модели для персонализированной медицины на основе реальных клинических данных остается нетривиальной задачей.
Как правило, проверка прогностической модели основывается на соответствующем экспериментальном дизайне и рандомизации. Реальные данные часто ограничивают возможности тщательной проверки. Классические стратегии, такие как тщательно разработанные схемы перекрестной проверки, могут предложить надежную проверку, но их может быть сложно разработать, и необходимо правильно понимать пределы такой ретроспективной проверки.Другой вариант — использование разных временных окон, в которых для разработки модели используются только ретроспективные данные до заданной даты, которые затем используются для данных, доступных после этой даты. Такая установка может быть близка к реальной предполагаемой оценке, хотя риск систематических ошибок выше. Другой вариант — рассматривать такие анализы только как генерирующие гипотезы, за которыми затем следуют более классическим способом, проводя тщательно разработанное наблюдательное исследование, демонстрирующее окончательную проверку.Более спекулятивная возможность — это адаптация так называемых методов A / B-тестирования, которые распространены в веб-разработке и разработке программного обеспечения [47]. Это повлечет за собой рандомизацию пациентов для выбора терапевтических вариантов непосредственно в реальной среде. Хотя такие условия, вероятно, неприменимы для разработки лекарств, они могут быть применимы для определения эффективности вмешательств в реальных условиях или для определения подходящей группы пациентов для данного вмешательства.
Мультимодальные данные пациента
Доступность многомасштабных и многомодальных продольных данных пациента растет.Примеры включают Инициативу по нейровизуализации болезни Альцгеймера (http://adni.loni.usc.edu/) (омикс, нейровизуализация, продольные клинические данные), Инициативу по маркерам прогрессирования болезни Паркинсона (http://www.ppmi-info.org /) (омики, нейровизуализация, лонгитюдные клинические данные), All-of-Us Cohort (https://allofus.nih.gov/) (омики, поведенческие, EMR, экологические данные), проект GENIE (http: //www.aacr.org/Research/Research/Pages/aacr-project-genie.aspx#.WvqxOPmLTmE) (геномные и лонгитюдные клинические данные реального мира) и, в частности, для мультиомиков, Genomic Data Commons NCI [48 ].Мультимодальные данные предоставляют уникальные возможности для персонализированной медицины, поскольку они позволяют фиксировать и понимать различные параметры пациента. Этот аспект, в свою очередь, широко считается ключевым для повышения эффективности прогнозирования алгоритмов стратификации до уровня, полезного для клинической практики. Соответственно, было много работы над методами, объединяющими данные из разных (омических) модальностей, см. Обзор [49].
Основным узким местом в текущих исследованиях по сбору различных методов данных по клиническим когортам является тот факт, что разные исследования часто проводятся на когортах разных пациентов и в исследованиях используются разные экспериментальные подходы (см.рис.5 для примера). Как следствие, данные из разных исследований становится трудно или даже невозможно интегрировать в общую модель машинного обучения. В будущем возможно несколько способов уменьшить эту проблему. Первая стратегия заключается в проведении систематической многомодальной оценки данных каждого человека в когорте, строго охарактеризованной клинически, включая длительное клиническое и последующее наблюдение. В более классической клинической обстановке успех Framingham Heart Study (https: // www.framinghamheartstudy.org/), которое представляет собой долгосрочное исследование факторов риска сердечно-сосудистых заболеваний, проводимое с 1948 года. Хотя в будущем мы будем анализировать все большие и большие объемы реальных данных, мы должны знать о ограничения таких данных (совместимость данных из разных источников, несистематически собираемые данные, качество измерений, несоответствия и ошибки и т. д.). Тщательные многомодальные наблюдательные исследования необходимы для установления надежной основы для разработки моделей реального мира.В идеале, мультимодальные данные должны собираться продольно через равные промежутки времени для всех субъектов. Хотя это было достигнуто для отдельных исследований [50], по практическим и экономическим причинам это, вероятно, будет ограничено небольшим числом когорт. Второй подход состоит в том, чтобы у пациентов разных когорт было некоторое совпадение. Затем можно использовать статистические методы и машинное обучение, чтобы «связать» разные наборы данных вместе. Третий подход — собрать совместный метод (например, стандартизированные клинические данные или биомаркеры) в разных исследованиях.Эта совместная модальность снова позволяет связать воедино разные наборы данных. Следует подчеркнуть, что эта проблема разрозненных когорт в настоящее время является серьезным препятствием для использования данных по мультикомиксам.
Рис. 5Перекрытие различных объектов данных omics и клинических данных в когорте AddNeuroMed Alzheimer’s Disease из EMIF-AD (http://www.emif.eu/about/emif-ad). Цифры относятся к пациентам, для которых доступна конкретная модальность данных.
Следует подчеркнуть, что в идеале мультимодальные, многопрофильные данные следует рассматривать в сочетании с лонгитюдными клиническими данными.Несмотря на приведенные выше примеры (Инициатива по нейровизуализации болезни Альцгеймера, Инициатива по маркерам прогрессирования болезни Паркинсона, All-of-Us Cohort), мы в настоящее время только начинаем проводить соответствующие исследования на более систематической основе. Комбинация мультиомиксов с реальными продольными данными из клинической практики (например, EMR) и мобильными приложениями здравоохранения отмечает дальнейший потенциал персонализированной медицины в будущем. Проект GENIE — важный шаг в этом направлении.
Внедрение алгоритмов стратификации в клиническую практику
Способность ускорять инновации в лечении пациентов связана с нашей способностью переводить все более сложные и мультимодальные алгоритмы стратификации от открытия к проверке. Стратификация в клиническом применении означает назначение спецификаций лечения конкретному пациенту, которые могут включать тип, дозировку, момент времени, доступ к лечению и другие фармакологические аспекты. Валидация таких алгоритмов обычно выполняется посредством внутренней валидации (перекрестная валидация), внешней валидации (с использованием отдельной когорты пациентов) и проспективных клинических испытаний по сравнению со стандартом оказания помощи [10] (http: // www.agendia.com/healthcare-professionals/the-mindact-trial/). Надлежащая проверка представляет собой требование для преобразования этих методов в условия, в которых они могут оказать влияние на результаты лечения пациентов. В дополнение к классическим поставщикам медицинских услуг, таким как больницы и терапевты, в будущем все большую роль могут играть мобильные медицинские приложения и носимые датчики. Как описано ранее, интеграция мультимодальных данных является ключом к получению нового понимания и также лежит в основе стратификации пациентов для диагностических, прогностических или прогностических целей.Однако существуют значительные препятствия в отношении интеграции схожих данных из разных когорт, нормализации данных на разных платформах измерения, а способность обрабатывать очень большие объемы данных в соответствующих системах, близких к клинической инфраструктуре или внутри нее, остается ограниченной. Строго контролируемые облачные сервисы, которые должным образом защищают данные пациентов, могут быть подходом к ослаблению этого ограничения [51]. На этом этапе можно было бы поучиться у организаций, которые сегодня обрабатывают крупномасштабные клинические данные реального мира (в основном в США).Однако их подходы, возможно, придется адаптировать к правовой среде каждой конкретной страны.
В настоящее время внедрение алгоритмов стратификации пациентов в клиническую практику также затруднено из-за нормативных аспектов. Перспективные клинические испытания, необходимые для утверждения диагностических инструментов регулирующими органами, очень дороги, а поиск спонсоров — сложный. Одной из возможностей снижения связанных барьеров может быть поэтапный подход с начальными пилотными исследованиями, чтобы продемонстрировать ценность, которую можно получить для пациентов, устойчивости здравоохранения, переводческой науки и экономической эффективности.Такие проекты должны продемонстрировать принципиальную ценность стратификации пациентов. Более того, они могут дать содержательную информацию о биологии болезни (с помощью биомаркеров). В идеале эти результаты должны измеряться продольно после стратификации на основе машинного обучения и, таким образом, обеспечивать петлю обратной связи, которая помогает улучшить алгоритм стратификации.
Распространенным мифом является то, что инновации в области здравоохранения основаны на парадигме построения и замораживания (https://www.theatlantic.com/technology/archive/2017/10/algorithms-future-of-health-care/ 543825 /), что означает, что программное обеспечение создается, замораживается, а затем тестируется в неизменном виде в течение всего срока его службы.Однако разработка более совершенных алгоритмов стратификации потребует более плавной схемы обновления. В последние годы произошли интересные изменения в области регулирования и управления рисками для систем непрерывного обучения. Примером такого развития является программа предварительной сертификации (Pre-Cert) программного обеспечения для цифрового здравоохранения (https://www.fda.gov/MedicalDevices/DigitalHealth/DigitalHealthPreCertProgram/Default.htm), недавно запущенная FDA. PreCert нацелен на изучение и адаптацию своих ключевых элементов в зависимости от эффективности программы.Кроме того, лаборатории по улучшению клинической лаборатории (CLIA; https://www.fda.gov/MedicalDevices/DeviceRegulationandGuidance/IVDRegulatoryAssistance/ucm124105.htm) предоставляют образец того, как связанные со здоровьем программные инструменты, разработанные для информирования о точной медицине, могут быть проверены в ясный и прозрачный способ, так как инструмент постоянно обновляется. Лаборатории CLIA — это сертифицированные лаборатории, которые проходят процесс регулярных сертификатов, контролируемых FDA и другими регулирующими органами в США. Эти лаборатории должны следовать утвержденным и задокументированным стандартным рабочим процедурам.Они могут использовать медицинские устройства, которые могут включать программное обеспечение для диагностики, при условии, что они используют такие Стандартные рабочие процедуры и отказываются от процесса сертификации (https://wwwn.cdc.gov/clia/Resources/WaivedTests/default.aspx). Самое главное, что разработчик инструмента может обновлять программное обеспечение. Лаборатории CLIA независимы при принятии решения о том, будут ли они повторно проверять программное обеспечение, и могут ли они принять стратегию, которая наилучшим образом соответствует технологическим темпам разработки программного обеспечения и их клиническим потребностям в отношении расширения возможностей или повышения производительности.Например, лаборатория может принять решение проверять только выпуски основной версии, например переход с версии 1.x на 2.0, и включать выпуски дополнительных версий на лету.
Видение точной медицины — обеспечить правильное вмешательство нужному пациенту в нужное время и в нужной дозе. Описанные подходы, основанные на повторяющейся обратной связи между разработчиками и клиническими конечными пользователями, могут повысить нашу способность лучше адаптировать алгоритмы стратификации к новым представлениям в биологии болезней, доступу к новым молекулярным данным и изменениям в клинических условиях.
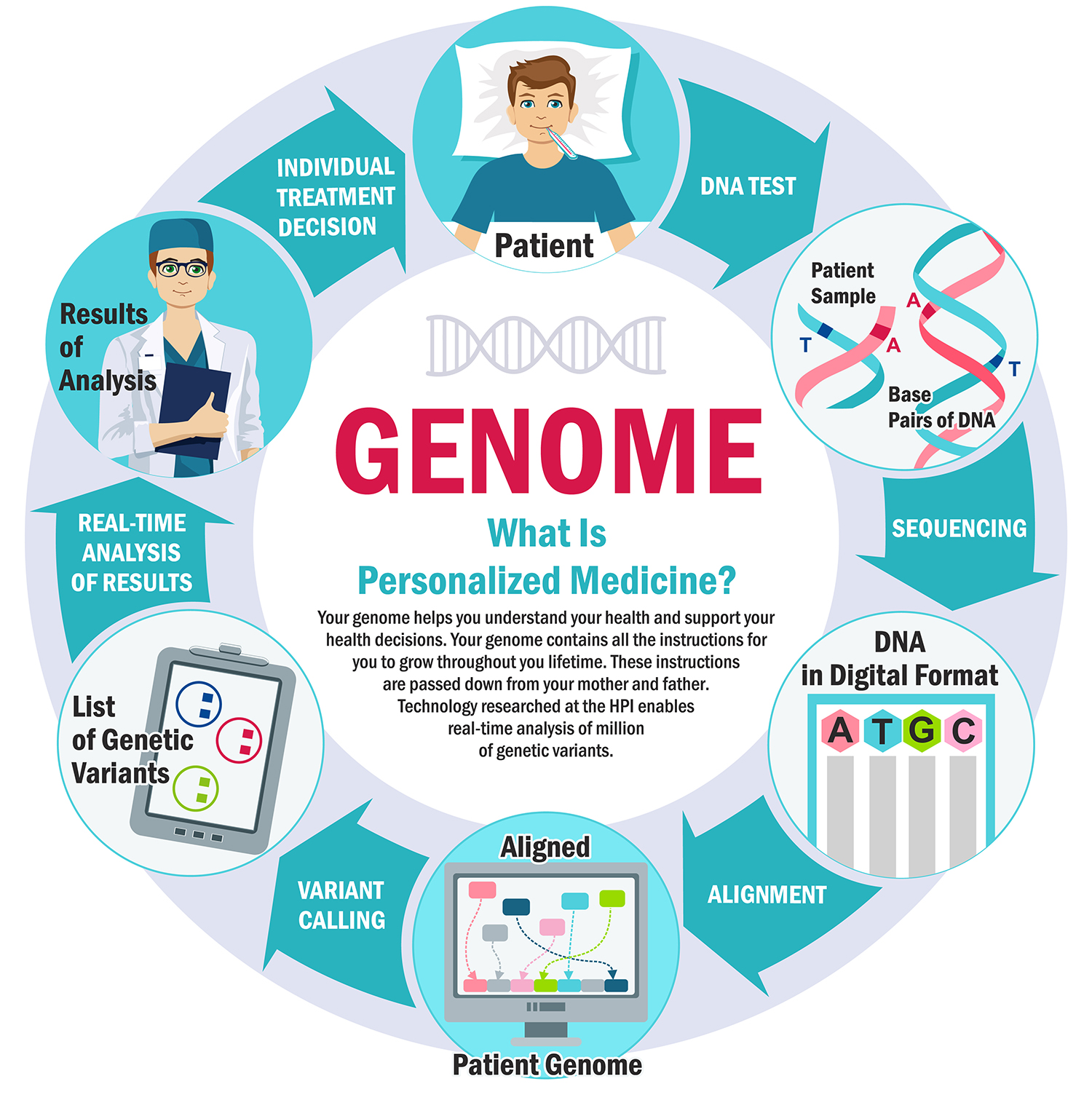 ВИПОЛ, Київ, 320 с.
ВИПОЛ, Київ, 320 с. Small, 3(11): 1840–1854.
Small, 3(11): 1840–1854.
 Korean Circ. J., 39(4): 129–137.
Korean Circ. J., 39(4): 129–137. J. Nanosci. Nanotechnol., 8(5): 2216–2229.
J. Nanosci. Nanotechnol., 8(5): 2216–2229. Genomics, 93(2): 105–111.
Genomics, 93(2): 105–111. Nano Lett., 10(8): 3163-3167.
Nano Lett., 10(8): 3163-3167. J. (2009) RNAi-based therapeutics-current status, challenges and prospects. EMBO Mol. Med., 1(3): 142–151.
J. (2009) RNAi-based therapeutics-current status, challenges and prospects. EMBO Mol. Med., 1(3): 142–151.

/GettyImages-525440711-56e994ac3df78cb4b97b82a1.jpg)
 2017; 92: 1711.
2017; 92: 1711. Рочестер, Миннесота: Фонд медицинского образования и исследований Мэйо, 2018.
Рочестер, Миннесота: Фонд медицинского образования и исследований Мэйо, 2018.